保健食品理化及卫生指标检验与评价技术指导原则(2020年版)
2023-07-15 11:34:46
来源:
目 录
第一部分 总则 3
一、主题内容和适用范围 4
二、基本要求 5
第二部分 功效成分/标志性成分检验方法 7
一、保健食品中红景天苷和酪醇的测定 8
二、保健食品中大蒜素的测定
三、保健食品中芦荟苷的测定
四、保健食品中左旋肉碱的测定
五、保健食品中α-亚麻酸、γ-亚麻酸的测定
六、保健食品中人参皂苷的测定
七、保健食品中前花青素的测定 31
八、保健食品中核苷酸的测定
九、保健食品中洛伐他汀的测定
十、保健食品中槲皮素、山柰素、异鼠李素的测定
十一、保健食品中茶氨酸的测定
十二、保健食品中五味子醇甲、五味子甲素和乙素的测定
十三、保健食品中腺苷的测定
十四、保健食品中总皂苷的测定
十五、保健食品中总黄酮的测定
十六、保健食品中壳聚糖脱乙酰度的测定
十七、保健食品中总蒽醌的测定
十八、保健食品中10-羟基-2-癸烯酸的测定
十九、保健食品中绞股蓝皂苷XL IX的测定
二十、保健食品中总三萜的测定
二十一、保健食品中虫草素的测定
二十二、保健食品中D-甘露醇的测定
二十三、保健食品中功效成分/标志性成分食品安全国家标准检测方法 89
第三部分 溶剂残留的测定 90
第四部分 违禁成分的测定 95
第一部分 总则
一、主题内容和适用范围
1.本指导原则规定了保健食品及其原料、辅料理化及卫生指标检验与评价的基本要求、功效成分/标志性成分检验方法、溶剂残留和违禁成分的测定要求。
2.本指导原则适用于保健食品的注册和备案检验。
二、基本要求
1. 保健食品应符合《食品安全国家标准 保健食品》(GB 16740)的各项要求和检验方法规定。对于不同配方、不同形态、不同工艺的产品,申请人应同时制定符合要求的理化、功效成分/标志性成分、微生物等指标对产品质量进行有效控制。
2. 直接接触保健食品的包装材料应符合相应食品安全国家标准及相关规定。
3. 普通食品形态产品应检测并制定净含量及允许负偏差指标,指标应符合《定量包装商品净含量计量检验规则》(JJF 1070)规定。胶囊等非普通食品形态产品应制定装量或重量差异指标。装量或净含量只检测内容物,不包括隔离材料。
4. 最小服用单元含有惰性隔离材料填充的产品,如胶囊,其功效成分或者指标成分、农药残留、灰分、水分等指标以去除隔离材料(胶囊壳)的内容物为检测单元,对于非法添加药物、重金属、铬、色素(如材料带颜色)等则需要进行整体检测,或者检测结果明确标识相关检测部位。
5. 本指导原则第二部分提供的检测方法为推荐方法,注册申请人在对产品进行功效成分/标志性成分检测时,应选择适合相应产品的检测方法。申请注册检验时,应提供该产品的配方、工艺、产品技术要求及功效成分/标志性成分检测方法以及检测方法的适用性、重现性等方法学研究材料。检测方法应科学、适用、重现。注册检验机构对所附材料进行审核,必要时进行有关验证和方法确认,如申报单位提供的方法不适合送检的样品时,注册检验机构不得擅自修改,应将有关情况反馈申报单位,由其进行研究并提供方法后,再对送检样品进行试验,确保试验方法与送检产品技术要求中规定的方法一致。复核检验机构应按照申报单位提交的检验方法进行检验并出具复核检验报告。
6. 注册申请人应当自行开展或委托具备法定资质的注册检验机构,按照国家相关规定和标准等要求,根据样品具体情况,合理地进行稳定性试验设计和研究。通过稳定性试验,考察样品在不同环境条件下(如温度、相对湿度等)的化学、物理及生物学特征随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。产品稳定性重点考察指标,主要包括感官、微生物、崩解时限(溶散时限、溶化性等)、水分、pH值、酸价、过氧化值、列入理化指标中的特征成分等随储存条件和储存时间容易发生变化的指标。产品非稳定性重点考察指标,主要包括鉴别、灰分、污染物(如铅、总砷、总汞等)、真菌毒素、农残(如六六六、滴滴涕等)、国家相关标准及现行规定有用量限制的合成色素和甜味剂等随储存条件和储存时间不易发生变化的指标,以及国家相关标准及现行规定有用量限制的抗氧化剂指标。
稳定性试验为注册申请人自行开展的,组织实施的检验质量控制、报告编制、样品和档案管理等工作以及出具的报告格式内容,应当符合有关规定。稳定性试验为注册申请人委托检验的,被委托单位应当为具有法定资质的食品检验机构。
7. 标准规定不得检出的项目结果,检测结果在方法定量限以上时,按照具体检出值报送结果;检测结果在方法检出限以下时,注明“未检出,检出限值”;检测结果在方法检出限以上、定量限以下时,注明“检出且小于定量限,定量限值,检出限值”。
8. 保健食品中原料和辅料应符合保健食品原辅料质量要求的有关规定,有适用的国家相关标准、地方标准、行业标准等的,其质量应符合相关规定。原辅料质量要求内容有缺项难以或无需制定的,应说明原因。原料若为植物提取物或者原料及辅料加工过程中使用、间接引入有机溶剂时,涉及的有机溶剂应符合《食品安全国家标准 食品添加剂使用标准》(GB 2760)附录C中食品工业用加工助剂使用名单规定,或有关规定。企业可根据产品质量控制需要,采用本指导原则中第三部分溶剂残留的测定方法将溶剂残留检测列入原料或产品的技术要求。
9. 违禁成分的检测作为相应保健功能类别产品的功能试验样品注册检验要求,应当符合本指导原则第四部分的规定。
第二部分
功效成分/标志性成分检验方法
一、保健食品中红景天苷和酪醇的测定
1 范围
本方法规定了以红景天为主要原料的保健食品中红景天苷和酪醇的液相色谱测定方法。
本方法适用于保健食品中红景天苷和酪醇的测定。
2 原理
试样经甲醇超声提取,以0.01mol/L乙酸铵-甲醇为流动相(80+20),采用高效液相色谱法,紫外检测器检测,根据保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 乙酸铵(CH3COONH4)。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 甲醇(CH3OH)。
3.2 标准品
红景天苷、酪醇标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 红景天苷、酪醇标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 红景天苷标准储备液(2.0mg/mL):准确称取红景天苷标准品20mg(精确至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,摇匀。
3.3.2 红景天苷标准工作液:将红景天苷标准储备液(3.3.1)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.20mg/mL、0.50mg/mL,临用时配制。
3.3.3 酪醇标准储备液(2.0mg/mL):准确称取酪醇标准品20mg(精确至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,摇匀。
3.3.4 酪醇标准工作液:将酪醇标准储备液(3.3.3)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.10mg/mL、0.20mg/mL,临用时配制。
3.3.5 系统适用性溶液:量取红景天苷标准储备液(3.3.1)和酪醇标准储备液(3.3.3)各0.5mL于10mL容量瓶中,用甲醇(3.1.2)稀释至刻度,摇匀。
3.4 试剂配制
乙酸铵溶液(0.01mol/L):称取0.77g乙酸铵,加入适量水溶解并定容至1000mL,经0.45μm滤膜(3.5.1)过滤后备用。
3.5 材料
3.5.1 水相微孔滤膜:0.45µm。
3.5.2 有机相微孔滤膜:0.45µm。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外检测器(UV)。
4.2 超声波清洗器。
4.3 分析天平:感量为0.01mg和0.0001g。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:准确称取已粉碎混合均匀的固体待测试样适量(约含红景天苷5mg)于 25mL容量瓶中,加入甲醇(3.1.3)约20mL,超声提取30min,放冷至室温,用甲醇(3.1.3)定容至刻度。混匀后经0.45μm滤膜(3.5.2)过滤,供液相色谱分析用。
5.1.2 液体样品:准确吸取摇匀后的待测试样适量(约含红景天苷5mg),置于蒸发皿内,水浴蒸干,用甲醇溶解并(3.1.3)转移至25mL容量瓶中并定容至刻度。混匀后经0.45μm滤膜(3.5.2)过滤,供液相色谱分析用。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm, 5μm,或同等性能色谱柱;
5.2.2 流动相:乙酸铵溶液(0.01mol/L)-甲醇(80+20);
5.2.3 流速:1.0mL/min;
5.2.4 柱温:25℃;
5.2.5 检测波长:215nm;
5.2.6 进样量:10mL。
5.2.7 系统适用性试验:取系统适用性溶液(3.3.5)10mL,注入液相色谱仪,记录色谱图,红景天苷峰与酪醇峰的分离度应大于1.5。
5.3 标准曲线的制作
将红景天苷标准系列工作液(3.3.2)或酪醇标准系列工作液(3.3.4)分别注入高效液相色谱仪中,测定相应的色谱峰高或峰面积,以标准工作液的浓度为横坐标,以峰面积或峰高为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1)。
5.4 试样溶液的测定
将试样待测液(5.1.1或5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积或峰高,根据标准曲线得到待测液红景天苷或酪醇的浓度(样品溶液液相色谱图见附录A中图A.2)。
6 结果计算
试样中红景天苷或酪醇含量按下式计算: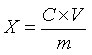
X—试样中红景天苷或酪醇的含量,单位为毫克每克或毫克每毫升(mg/g或mg/mL);
C—由标准曲线查得待测样液中红景天苷或酪醇的浓度,单位为毫克每毫升(mg/mL);
V—样品的定容体积,单位为毫升(mL);
m—样品量,单位为克或毫升(g或mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录 A
标准溶液和试样溶液典型液相色谱图
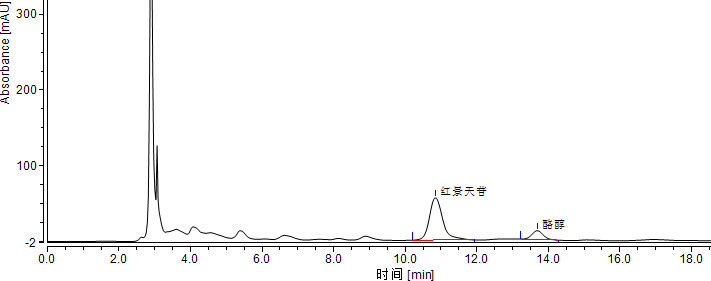
二、保健食品中大蒜素的测定
1 范围
本方法规定了保健食品中大蒜素(二烯丙基三硫化物)的测定方法。
本方法适用于以大蒜及其加工品为主要原料制成的保健食品中大蒜素(二烯丙基三硫化物)的测定。
2 原理
试样经有机溶剂提取,通过气相色谱检测,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯。
3.1 试剂
3.1.1 无水乙醇(C2H5OH)。
3.1.2 正己烷(CH3(CH2)4CH3)。
3.1.3 无水硫酸钠(Na2SO4)。
3.2 标准品
大蒜素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99.0%,或经国家认证并授予标准物质证书的标准物质。
表1 大蒜素标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 大蒜素标准储备液(5.0mg/mL):称取125.0mg大蒜素于25mL容量瓶中,用正己烷(3.1.2)定容至刻度,摇匀。此溶液可在4℃冰箱中保存七天。
3.3.2 大蒜素标准工作液:分别准确吸取不同体积的标准储备液(3.3.1),用正己烷(3.1.2)将其稀释成大蒜素含量分别为0.1mg/mL、0.5mg/mL、1.0mg/mL、1.5mg/mL、2.0mg/mL的标准系列工作溶液,临用配制。
3.4 材料
微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 气相色谱仪:配有氢火焰离子化检测器(FID)。
4.2 分析天平:感量为0.01mg和0.0001g。
4.3 超声清洗器。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的固体待测试样适量(含待测组分约5mg,精确到0.0001g)于5mL容量瓶中,加无水乙醇2.5mL,密塞,超声(功率800W,频率40kHz)提取20min,取出冷却至室温,加正己烷定容,摇匀,过0.45μm微孔滤膜过滤,待上机测试用。
5.1.2 油状试样
称取已混合均匀的油状待测试样适量(含待测组分约5mg,精确到0.0001g)于5mL容量瓶中,加正己烷溶解并定容,摇匀,过0.45μm微孔滤膜过滤,待上机测试用。
5.1.3 含水液体试样
精密吸取已混合均匀的待测试样适量(含待测组分约10mg),置于分液漏斗中,加4mL正己烷振摇提取1min,静置分层,取上层清液过无水硫酸钠,提取两次。用适量正己烷冲洗无水硫酸钠,合并至同一10mL容量瓶中,用正己烷定容至刻度,摇匀。过0.45μm微孔滤膜过滤,待上机测试用。
5.2 仪器参考条件
5.2.1 色谱柱:(5%-苯基)-甲基聚硅氧烷固定相,柱长30m,内径0.25mm,膜厚0.25μm或其他同等性能色谱柱。
5.2.2 柱温箱温度:起始温度100℃保持3min,10℃/min速度升至150℃,再以20℃/min速度升至200℃,保持20min。
5.2.3 进样口温度:220℃。
5.2.4 检测器温度:250℃。
5.2.5 载气:高纯氮气,流量1.0mL/min。
5.2.6 氢气:40mL/min;空气:400mL/min。
5.2.7 进样量:1μL。
5.3 测定
将1μL的标准工作溶液(3.3.2)和试样溶液(5.1)注入气相色谱仪中,以保留时间定性,测得峰面积或峰高,外标法定量。
标准工作溶液图谱及试样溶液图谱见附录A。
6 结果计算
试样中大蒜素含量按下式计算:
W—大蒜素的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
A1—试样溶液色谱峰面积或峰高;
A2—标准工作液峰面积或峰高;
C—标准工作液浓度,单位为毫克每毫升(mg/mL);
V—试样定容体积,单位为毫升(mL);
m—试样的质量或体积,单位为克或毫升(g或mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型气相色谱图


三、保健食品中芦荟苷的测定
1 范围
本方法规定了保健食品中芦荟苷含量的高效液相色谱测定方法。
本方法适用于以芦荟及其加工品为主要原料的保健食品中芦荟苷含量的测定。
2 原理
样品用甲醇+水(55+45)作为溶剂,提取试样中的芦荟苷,经C18柱分离,在293nm波长处检测,以芦荟苷保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 石油醚:沸程30℃~60℃。
3.2 标准品
芦荟苷标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥90%,或经国家认证并授予标准物质证书的标准物质。
表1 芦荟苷标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 芦荟苷标准储备液:称取芦荟苷标准样品(3.2)10mg(精确至0.01mg)于25mL容量瓶中,加流动相溶解并定容至刻度,摇匀,此溶液浓度为0.4mg/mL。临用新配。
3.3.2 芦荟苷标准系列工作液:分别准确吸取芦荟苷标准储备液(3.3.1)0.5mL、1.0mL、2.0mL、4.0mL、6.0mL至10mL容量瓶中,用流动相定容,得浓度为0.02mg/mL、0.04mg/mL、0.08mg/mL、0.16mg/mL、0.24mg/mL的标准系列工作液。
3.4 微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 超声波清洗器。
4.3 分析天平:感量分别为0.01mg和0.001g。
4.4 离心机:转速≥3000r/min。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的待测试样适量(约含芦荟苷4mg,精确到0.001g),置具塞锥形瓶中,加入50.0mL流动相(5.2.2),称重,超声处理20min,放冷,用流动相补足减失的重量,摇匀,经微孔滤膜(3.4)过滤,滤液待测。必要时可进行适当稀释。
5.1.2 含油基质试样
称取已粉碎混合均匀的待测试样适量(约含芦荟苷4mg,精确到0.001g),置具塞锥形瓶中,加入25.0mL石油醚(3.1.2),涡旋使充分混匀,过滤,弃去石油醚液,再用少量石油醚洗涤锥形瓶及滤纸,挥干,将滤纸和残渣置于原具塞锥形瓶中,加入50.0mL流动相(5.2.2),称重,超声处理20min,放冷,用流动相补足减失的重量,摇匀,经微孔滤膜(3.4)过滤,滤液待测。必要时可进行适当稀释。
5.1.3 水性液体试样
吸取待测试样,必要时以流动相(5.2.2)适当稀释,离心,取上清液经微孔滤膜(3.4)过滤。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm,5μm,或性能相当者。
5.2.2 流动相:甲醇(3.1.1)+水,(55+45,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:40℃。
5.2.5 检测波长:293nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的芦荟苷标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液芦荟苷的色谱峰面积,根据标准曲线得到待测液中芦荟苷的浓度,平行测定次数不少于两次。
芦荟苷的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中芦荟苷含量按下式计算: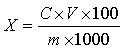
X—试样中芦荟苷的含量,单位为克每百克(g/100g)或克每百毫升(g/100mL);
C—由标准曲线得出的样液中芦荟苷的浓度,单位为毫克每毫升(mg/mL);
V—试样的最终定容体积,单位为毫升(mL);
m—试样取样量,单位为克(g)或毫升(mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
芦荟苷的高效液相色谱图
四、保健食品中左旋肉碱的测定
1 范围
本方法规定了保健食品中左旋肉碱的液相色谱测定方法。
本方法适用于以左旋肉碱为主要原料的保健食品中肉碱的含量测定。
2 原理
试样中的左旋肉碱以0.50mmol/L的盐酸溶液经超声提取,反相色谱分离,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 磷酸氢二钾(K2HPO4)。
3.1.2 辛烷磺酸钠(C8H17NaO3S)。
3.1.3 盐酸(HCl):含量:36%~38%。
3.1.4 磷酸(H3PO4)。
3.1.5 硅藻土(SiO2):粒径范围:0.2-0.8mm。
3.1.6 乙腈(CH3CN):色谱纯。
3.2 标准品
左旋肉碱标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 左旋肉碱标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 左旋肉碱标准储备液:称取25mg(准确至0.01mg)左旋肉碱标准品(3.2)于25mL容量瓶中,用盐酸溶液(3.4)溶解并定容至刻度,摇匀。此溶液浓度为1.0mg/mL。
3.3.2 左旋肉碱标准系列工作液:分别准确吸取左旋肉碱标准储备液(3.3.1)0.50mL、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL于5mL容量瓶中,用盐酸溶液(3.4)稀释至刻度,得浓度分别为0.10mg/mL、0.20mg/mL、0.40mg/mL、0.60mg/mL、0.80mg/mL、1.00mg/mL的标准系列工作液。临用时配制。
3.4 盐酸溶液(0.5mmol/L):准确吸取4.2mL盐酸(3.1.3),用水定容至100mL。摇匀后,再吸取上述溶液1.0mL,用水定容至1L。
3.5 缓冲盐溶液:分别准确称取3.4g磷酸氢二钾(3.1.1)和0.4325g辛烷磺酸钠(3.1.2),用水溶解并定容至1L,摇匀,用磷酸(3.1.4)调至pH=2.5,经微孔滤膜(3.6)过滤,待用。
3.6 微孔滤膜:0.45μm,水相。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
4.2 分析天平:感量分别为0.01mg、0.0001g和0.001g。
4.3 超声波提取器:功率250W,频率33kHz。
5 分析步骤
5.1 试样制备
5.1.1 试样提取
5.1.1.1 固体试样
准确称取粉碎并混合均匀的试样0.1g~2g(准确至0.0001g,含待测组分约5mg~50mg),于50mL容量瓶中,加入盐酸溶液(3.4)约35mL,超声提取10min,放至室温,用盐酸溶液(3.4)稀释至刻度,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.1.2 软胶囊试样
取软胶囊剪开,挤出内容物并混匀,准确称取2g(准确至0.0001g),准确加入等量硅藻土(3.1.5),研至分散均匀,准确称取其中部分(准确至0.0001g,含待测组分约5mg~50mg),转移至250mL具塞三角瓶中,吸取盐酸溶液(3.4)50.0mL,并入三角瓶中,称重(准确至0.001g),加塞超声提取10min,放至室温,用盐酸溶液(3.4)补足重量,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.1.3 液体试样
准确吸取混匀后的试样1.0mL~5.0mL(含待测组分约5mg~50mg),于50mL容量瓶中,加入盐酸溶液(3.4)约35mL,超声提取10min,放至室温,用盐酸溶液(3.4)稀释至刻度,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.2 试样溶液稀释
必要时,根据试样溶液中左旋肉碱含量,用盐酸溶液(3.4)进行适当的稀释(稀释倍数F),使待测溶液中左旋肉碱的浓度在0.10mg/mL~1.00mg/mL范围内。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱: 250mm×4.6mm,5μm或同等性能的色谱柱。
5.2.2 流动相:缓冲盐溶液(3.5)+乙腈(3.1.6),(90+10,v/v)。
5.2.3 流速:0.8mL/min。
5.2.4 检测波长:210nm。
5.2.5 进样量:20μL。
5.3 标准曲线的制作
将左旋肉碱标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的左旋肉碱标准溶液的色谱峰面积。以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 待测溶液的测定
将待测溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的待测溶液左旋肉碱的色谱峰面积,根据标准曲线得到待测溶液中左旋肉碱的浓度,平行测定次数不少于两次。
左旋肉碱的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中左旋肉碱含量按下式计算: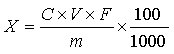
X—试样中左旋肉碱的含量,固体和软胶囊试样的单位为克每百克(g/100g),液体试样的单位为克每百毫升(g/100mL);
C—根据标准曲线计算待测溶液中左旋肉碱的浓度,单位为毫克每毫升(mg/mL);
V—试样提取时的定容体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);或液体试样吸取的体积,单位为毫升(mL);
F—稀释倍数;
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录 A
左旋肉碱的高效液相色谱图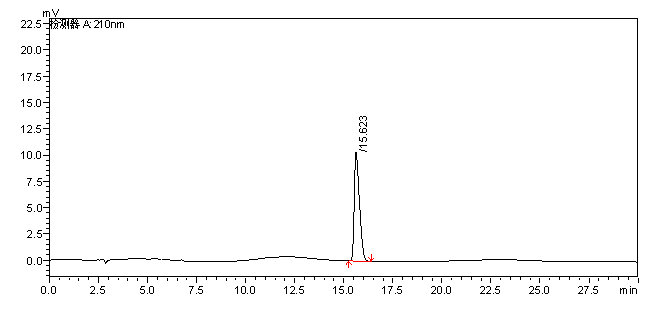
五、保健食品中α-亚麻酸、γ-亚麻酸的测定
1 范围
本方法规定了保健食品中α-及γ-亚麻酸的测定方法。
本方法适用于油脂类保健食品中α-及γ-亚麻酸含量的测定。
2 原理
将油脂试样(或试样提取的脂肪),经氢氧化钾皂化,在三氟化硼存在下甲醇酯化,然后用气相色谱仪分析,采用外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 正己烷(C6H14)。
3.1.2 氢氧化钾(KOH)。
3.1.3 三氟化硼甲醇溶液:浓度为15%。
3.1.4 甲醇(CH3OH):色谱纯。
3.1.5 氯化钠(NaCl)。
3.2 标准品
α-、γ-亚麻酸甲酯标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99.0%,或经国家认证并授予标准物质证书的标准物质。
表1 α-、γ-亚麻酸甲酯标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1标准储备液:称取α-亚麻酸甲酯、γ-亚麻酸甲酯标准品(3.2)各25.0mg(精确至0.01mg),分别置25mL容量瓶中,用正己烷(3.1.1)溶解并定容至刻度,溶液浓度为1.0mg/mL。贮存于-18℃冰箱中。
3.3.2 标准工作液:吸取α-亚麻酸甲酯和γ-亚麻酸甲酯标准储备液,稀释成含量分别为0.10mg/mL、0.20mg/mL、0.40mg/mL、0.50mg/mL的混合标准系列工作液。临用时配制。
3.4氢氧化钾甲醇溶液(0.5mol/L):称取氢氧化钾(3.1.2)2.8g,用甲醇(3.1.4)溶解并定容至100mL,混匀。
3.5 饱和氯化钠溶液:称取氯化钠(3.1.5)360g,溶解于1.0L水中,搅拌溶解,澄清备用。
4 仪器和设备
4.1 气相色谱仪:配有氢火焰(FID)检测器。
4.2 分析天平:感量分别为0.0001g和0.001g。
4.3 加热式磁力搅拌器。
4.4 标准磨口烧瓶(50mL)和直形冷凝管。
5 分析步骤
5.1 试样制备
5.1.1 脂肪的提取 按GB 5009.6中规定的方法提取。
5.1.2 皂化
称取0.100g油脂(或脂肪)和磁力搅拌子一并放入50mL磨口烧瓶中(见图1)加入4mL 0.5mol/L氢氧化钾甲醇溶液,上部连接回流冷凝管,并固定于磁力搅拌器上,由冷凝管上口向溶液中导入氮气,使反应瓶中始终充满氮气。开启磁力搅拌器,并加热使反应液保持65±5℃,搅拌回流约15min(至无油滴为止)。
5.1.3 甲酯化
从冷凝管上部加入4mL三氟化硼甲醇溶液,搅拌(65±5℃),回流约2min,冷至室温, 从冷凝管上部加入5mL正己烷继续搅拌5min,移去冷凝管,加入5mL饱和氯化钠水溶液, 摇动数分钟,转移至25mL分液漏斗中分离水与有机相,再加3mL正己烷洗水相,分离,弃水相,合并有机相并用正己烷定容至10.0mL(浓度低时吹氮浓缩至1.0mL),供测定用。
5.2 仪器参考条件
5.2.1 色谱柱:FFAP(改性聚乙二醇20M,30m×0.25mm i.d.0.25μm)
5.2.2 柱箱温度:215℃。
5.2.3 进样口温度:250℃。
5.2.4 检测器温度:260℃。
5.2.5 氮气:1.5mL/min,载气:50mL/min。
5.3定性分析
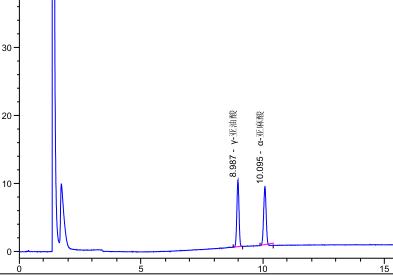
在上述仪器条件下,分别取标准储备液和试样测定液1.0μL,注入气相色谱仪,以保留时间来确定α-及γ-亚麻酸甲酯。
5.4 定量分析
试样中α-亚麻酸甲酯或γ-亚麻酸甲酯色谱峰面积或峰高与标准的比较定量。
标准样品溶液和试样溶液液相色谱图参见附录A的图A.1和图A.2。
6 结果计算
α-亚麻酸甲酯或γ-亚麻酸含量(以脂肪计)按下式计算:
X—α-亚麻酸或γ-亚麻酸含量(以脂肪计),g/100g;
A1—试样待测液中α-亚麻酸甲酯或γ-亚麻酸甲酯色谱峰面积或峰高;
A2—标准使用液色谱峰面积或峰高;
ρ—标准使用液浓度,mg/mL;
v—正己烷定容体积,mL;
m—试样质量,g;
0.952—亚麻酸换算系数。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。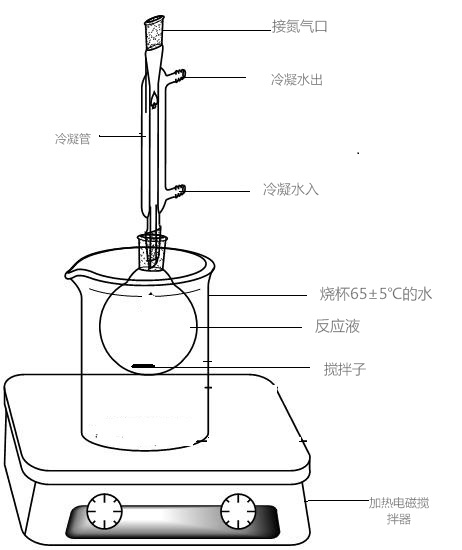
附录A
标准溶液和试样溶液典型液相色谱图
六、保健食品中人参皂苷的测定
1 范围
本方法规定了保健食品中人参皂苷的高效液相色谱测定方法。
本方法适用于以人参及其加工品为主要原料的保健食品中人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd含量的测定。
2 原理
将试样中的人参皂苷溶解、提取,经净化处理后,使用梯度洗脱反相高效液相色谱进行分离,紫外检测器检测(或蒸发光散射检测器),根据色谱峰的保留时间定性,外标法定量。
3 试剂和材料
注:水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 乙腈(CH3CN):色谱纯。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 D101大孔吸附树脂(粒径:I.D φ15*L150mm)。
3.2 标准品
人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 人参皂苷标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准储备液:分别称取人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准样品(3.2)100mg于6个10mL容量瓶中,用甲醇溶解并定容至刻度,摇匀,溶液浓度为10mg/mL。
3.3.2 人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd混合标准系列工作液:分别精密吸取不同体积的标准储备液(3.3.1)于同一10mL容量瓶中,用甲醇将其稀释成人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd含量分别为0.10mg/mL、0.20mg/mL、0.40mg/mL、0.80mg/mL、1.00mg/mL的混合标准系列工作液。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外检测器或蒸发光散射检测器。
4.2 超声波清洗器。
4.3 离心机。
4.4 水浴锅。
4.5 分析天平:感量分别为0.1mg和0.001g。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
取试样研成粉末,并过20目筛。称取该粉末样适量(相当于含总人参皂苷约75mg,精确至0.001g),于50mL容量瓶中,加水45mL于超声波清洗器中超声提取30分钟,取出,待放至室温后,加水定容至刻度,摇匀,滤过,准确吸取续滤液10mL,通过D101大孔吸附树脂净化柱(3.1.3)(大孔吸附树脂使用前先经甲醇浸泡,水洗,装成10cm长,直径1~1.5cm的小柱),小柱先用10mL水冲洗,弃去水液之后,用70%甲醇25mL洗脱皂苷,收集甲醇溶液,水浴上蒸干,残渣以甲醇(3.1.2)溶解并定容至5.0mL,该样液离心后过0.45μm尼龙滤膜,滤液进液相色谱仪分析。
5.1.2 液体试样
取一定量的试样(相当于含总人参皂苷约75mg),旋转蒸发至干,残渣以50mL水超声提取30分钟,余下步骤与5.1.1相同。
5.1.3 软胶囊试样
称取混合均匀的待测试样内容物适量(相当于含总人参皂苷约75mg,精确至0.001g),余下步骤与5.1.1相同。
5.2 色谱参考条件
5.2.1色谱柱:C18柱,250mm×4.6mm,5μm,或同等性能的色谱柱。
5.2.2流动相:A相为乙腈(3.1.1),B相为水,梯度洗脱条件见表2。
表2梯度洗脱条件
5.2.3 流速:1.0mL/min。
5.2.4 柱温:35°C。
5.2.5 进样量:5μL。
5.2.6 紫外检测器条件:检测波长:203nm。
5.2.7 蒸发光散射检测器条件:
蒸发温度:105°C;漂移管温度:60°C;气流速:1.6L/min。
5.3 标准曲线的制作
将混合标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的峰面积,以标准工作液的浓度(或浓度对数)为横坐标,以峰面积(或峰面积对数)为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,以保留时间定性,测得峰面积,根据标准曲线得到试样溶液中人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd的浓度。
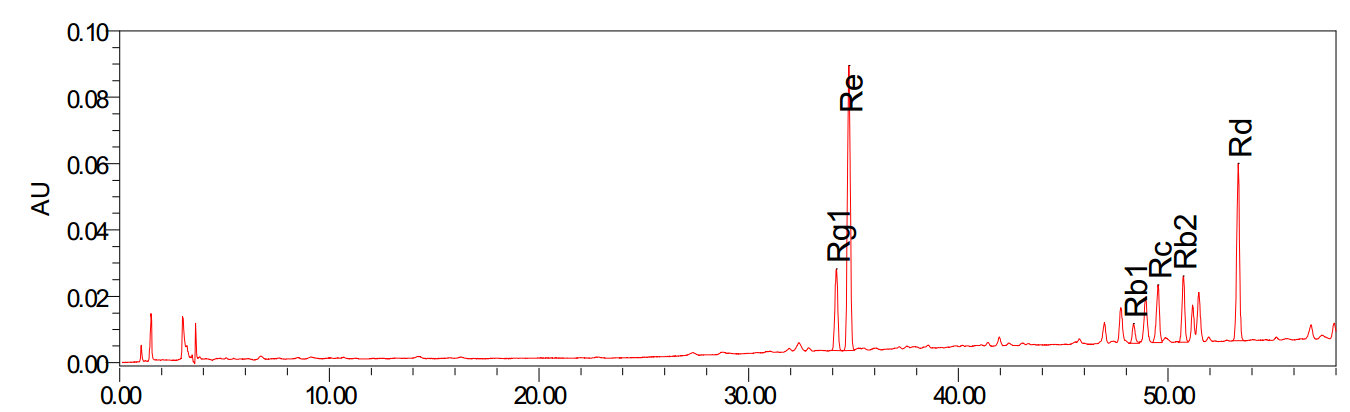
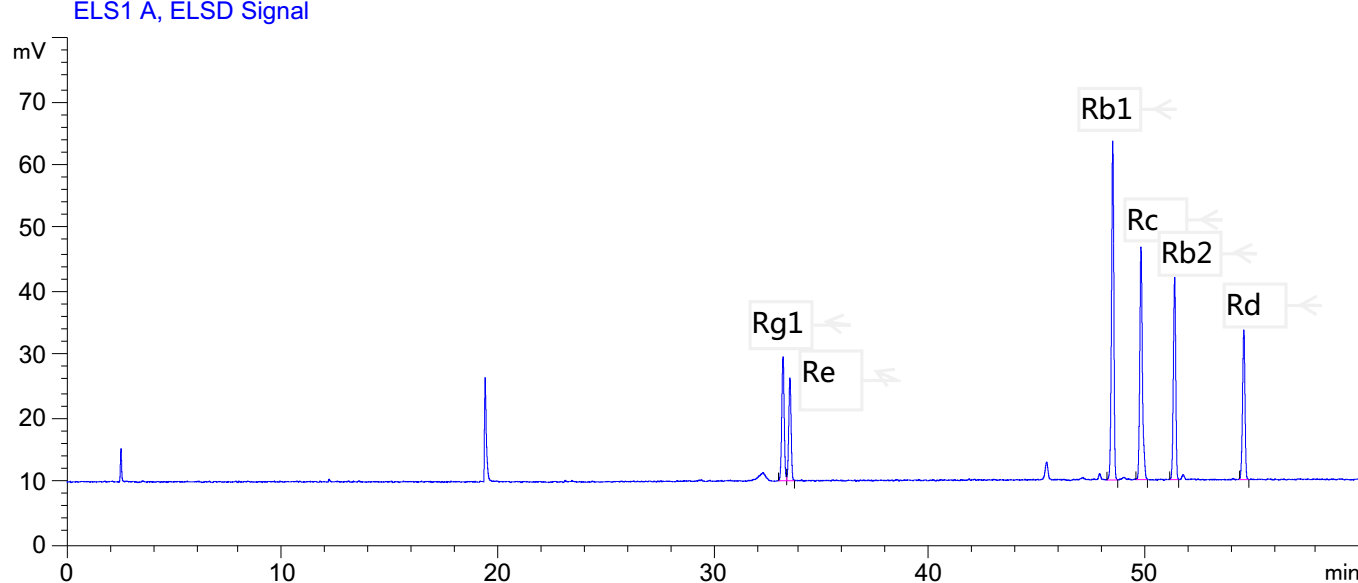
标准溶液和试样溶液的高效液相色谱图参见附录A(紫外检测器)和附录B(蒸发光散射检测器)。
6 结果计算
试样中各人参皂苷的含量按下式计算: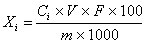
Xi——试样中各人参皂苷的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Ci——由标准曲线查得测定样液中各人参皂苷的浓度,单位为毫克每毫升(mg/mL);
V——被测定样液的最终定容体积,单位为毫升(mL);
F——被测定样液的稀释倍数;
m——试样的取样量,单位为克或毫升(g或mL);
100——单位转换;
1000——单位转换。
试样中总人参皂苷的含量按式(2)计算:
X总=XRe+XRg1+XRb1+XRc+XRb2+XRd………………(2)
式中:
X总—试样中总人参皂苷的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Xi—试样中各人参皂苷(Xi包括人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd)的含量,单位为克每百克或克每百毫升(g/100g或g/100mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图(紫外检测器)
附录B
标准溶液和试样溶液典型液相色谱图(蒸发光散射检测器)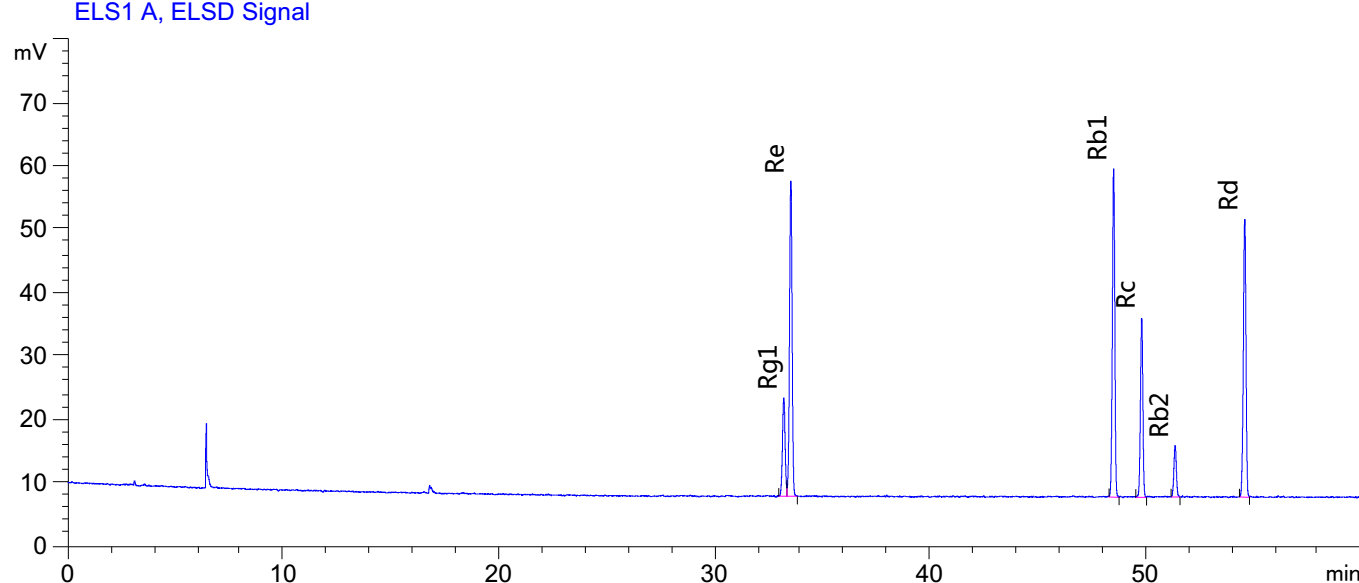
七、保健食品中前花青素的测定
1 范围
本方法规定了保健食品中前花青素的测定方法。
本方法适用于保健食品中前花青素的含量测定。
2 原理
前花青素是含有儿茶素和表儿茶素单元的聚合物。前花青素本身无色,但经过热酸处理后,可以生成深红色的花青素离子。本法用分光光度法测定前花青素在水解过程中生成的花青素离子。计算试样中前花青素含量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH)。
3.1.2 正丁醇(CH3(CH2)3OH)。
3.1.3 盐酸(HCl)。
3.1.4 硫酸铁铵(NH4Fe(SO4)2·12H2O)
3.2 试剂配制
3.2.1 盐酸(2mol/L):取盐酸90mL,加水适量使成500mL,摇匀。
3.2.2 硫酸铁铵溶液:称取10g硫酸铁铵,用2mol/L盐酸溶解并定容至500mL,混匀,此溶液中硫酸铁铵浓度为2%(w/v)。
3.3 标准品
前花青素(葡萄籽来源)标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥95%,或经国家认证并授予标准物质证书的标准物质。
表1 前花青素(葡萄籽来源)标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
说明:因为前花青素本身是一类物质(一般指2~4分子的聚合物),所以此标准样品为推荐使用。
3.4 标准品溶液的配制
前花青素标准储备液(1.0mg/mL):称取10mg(精确至0.1mg)前花青素标准品于10mL 容量瓶中,用甲醇溶解并定容至刻度,摇匀。
4 仪器和设备
4.1 分析天平:感量为0.1mg和0.001g。
4.2 分光光度计。
4.3 离心机:转速≥4000r/min。
4.4 超声仪。
4.5 回流装置。
5 分析步骤
5.1 试样制备
5.1.1 固体试样:称取已粉碎混合均匀的待测试样50mg~100mg(精确至0.1mg),置于50mL容量瓶中,加入30mL甲醇,超声处理20min,放冷至室温后,加甲醇至刻度,摇匀,离心或放置至澄清后取上清液备用。
5.1.2 含油试样:称取混合均匀的待测试样50mg(精确至0.1mg),置于小烧杯中,用20~30mL甲醇分数次搅拌,将提取液转移至50mL容量瓶中,直至甲醇提取液无色,加甲醇至刻度,摇匀。
5.1.3 液体试样:吸取不超过1mL的待测试样,置于50mL容量瓶中,加甲醇至刻度,摇匀。
5.2 试样测定
将正丁醇与盐酸按95:5的体积比混合后,取出6.0mL置于具塞锥形瓶中,再加入0.2mL硫酸铁铵溶液和1.0mL试样溶液,混匀,置沸水浴回流,精确加热40min后,立即置冰水中冷却,在加热完毕15min后,于546nm波长处测吸光度,由标准曲线计算试样中前花青素的含量。显色在1小时内稳定。
5.3 标准曲线制备
分别吸取前花青素标准储备液0.00mL、0.10mL、0.25mL、0.50mL、1.00mL、1.50mL置于10mL容量瓶中,加甲醇至刻度,摇匀。各吸取1.0mL测定,与试样测定方法相同。绘制前花青素浓度与吸光度关系的标准曲线。
6 结果计算
试样中前花青素测定结果按下式计算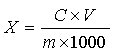
X—试样中前花青素的含量,g/100g;
C—由标准曲线上查出待测试样中前花青素的浓度,μg/mL;
V—待测试样定容总体积,mL;
m—试样质量,g。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
八、保健食品中核苷酸的测定
第一法
1 范围
本方法规定了保健食品中核苷酸的超高效液相色谱(UPLC)测定方法。
本方法适用于保健食品中核苷酸的测定。
2 原理
将试样溶解、去除蛋白后,经超高效液相色谱(UPLC)分离,以相对保留时间定性,峰面积定量。
3 试剂
注:除特殊说明,所用试剂均为分析纯,实验用水符合GB/T 6682一级水要求。
3.1 乙腈(CH3CN):优级纯。
3.2 乙酸(C2H4O2):36%~37%(g/g)。
3.3 磷酸(H3PO4)。
3.4 磷酸氢二钠(Na2HPO4)。
3.5 标准品
核苷酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥97%,或经国家认证并授予标准物质证书的标准物质。
表1:各核苷酸标准品的分子式、相对分子量、CAS登录号
3.6 标准溶液配制
3.6.1 核苷酸标准储备液:称取经100℃干燥4h处理的核苷酸标准品(3.5)各50mg(精确至0.1mg),用水溶解,并转移至100mL容量瓶中,定容至刻度,此溶液浓度为0.5mg/mL。
3.6.2 核苷酸标准系列工作液:分别准确吸取不同体积的标准储备液(3.6.1),用水将其稀释成核苷酸含量分别为10.0μg/mL、20.0μg/mL、40.0μg/mL、80.0μg/mL、100μg/mL的标准系列工作液。临用时配制。
4 仪器和设备
4.1 超高效液相色谱仪(UPLC):配有二极管阵列检测器或紫外检测器。
4.2 分析天平:感量分别为0.1mg和0.001g。
5 分析步骤
5.1 试样制备
5.1.1 不含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.22μm针孔滤膜,超液相色谱仪测定。
5.1.2 含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,加入乙酸(3.2)100μL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.22μm针孔滤膜,超高效液相色谱仪测定。
5.2 仪器参考条件
色谱柱:BEH Amide柱,2.1mm×100mm,1.7μm,或性能相当者。
流动相:A:乙腈、B:10mmol/L Na2HPO4水溶液、C:0.1%H3PO4水溶液,梯度洗脱。梯度表如下:
流速:0.5mL/min。
柱温:50℃。
检测波长:254nm。
进样量:1μL。
5.3 标准曲线的制作
将标准系列工作液(3.6.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的核苷酸标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定。
6 结果计算
试样中核苷酸测定结果按下式计算: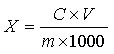
X-试样中核苷酸的含量,mg/g;
C-由标准曲线得出的试样溶液中核苷酸的浓度,μg/mL;
V-试样定容体积,mL;
m-试样称取的质量,g;
试样中总核苷酸的含量为胞嘧啶核苷(CMP)、尿嘧啶核苷(UMP)、腺嘌呤核苷(AMP)、鸟嘌呤核苷(GMP)、次黄嘌呤核苷(IMP)含量之和。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次测定结果的绝对差值不得超过算术平均值的10%。
第二法
1 范围
本方法规定了保健食品中核苷酸的高效液相色谱(HPLC)测定方法。
本方法适用于保健食品中核苷酸的测定。
2 原理
将试样溶解、去除蛋白后,经高效液相色谱分离,以相对保留时间定性,峰面积定量。
3 试剂
注:除特殊说明,所用试剂均为分析纯,实验用水符合GB/T 6682-2008一级水要求。
3.1 乙腈(CH3CN):优级纯。
3.2 乙酸(C2H4O2):36%~37%(g/g)。
3.3 磷酸(H3PO4)。
3.4 标准品
同方法一。
3.5 标准溶液配制
3.5.1 核苷酸标准储备液:称取经100℃干燥4h处理的核苷酸标准品(3.4)各50mg(精确至0.1mg),用水溶解,并转移至100mL容量瓶中,定容至刻度,此溶液浓度为0.5mg/mL。
3.5.2 核苷酸标准系列工作液:分别准确吸取不同体积的标准储备液(3.5.1),用水将其稀释成核苷酸含量分别为10.0μg/mL、20.0μg/mL、40.0μg/mL、80.0μg/mL、100μg/mL的标准系列工作液。临用时配制。
4 仪器和设备
4.1 液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 分析天平:感量分别为0.1mg和0.001g。
5 分析步骤
5.1 试样制备
5.1.1 不含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.45μm针孔滤膜,液相色谱仪测定。
5.1.2 含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,加入乙酸(3.2)100μL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.45μm针孔滤膜,液相色谱仪测定。
5.2 仪器参考条件
5.2.1 高效液相色谱
色谱柱:C18柱, 250mm×4.6mm,5μm,或性能相当者。
流动相:乙腈:0.2%H3PO4水溶液=97:3(V/V)。
流速:1mL/min。
柱温:35℃。
检测波长:254nm。
进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.5.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的核苷酸标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定。
6 结果计算
试样中核苷酸测定结果按下式计算: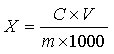
X-试样中核苷酸的含量,mg/g;
C-由标准曲线得出的试样溶液中核苷酸的浓度,μg/mL;
V-试样定容体积,mL;
m-试样称取的质量,g;
试样中总核苷酸的含量为胞嘧啶核苷(CMP)、尿嘧啶核苷(UMP)、腺嘌呤核苷(AMP)、鸟嘌呤核苷(GMP)、次黄嘌呤核苷(IMP)含量之和。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图(UPLC法)
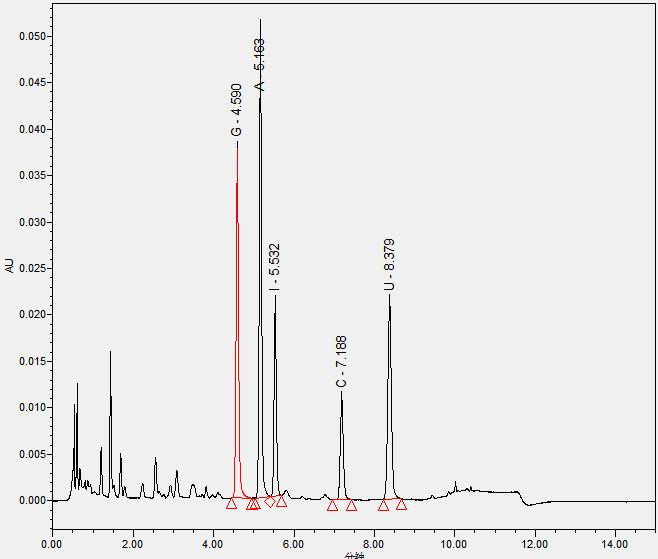
注:G:鸟嘌呤核苷(GMP);A:腺嘌呤核苷(AMP);I:次黄嘌呤核苷(IMP)
C:胞嘧啶核苷(CMP);U:尿嘧啶核苷(UMP)
附录B
标准溶液和试样溶液典型液相色谱图(HPLC法)
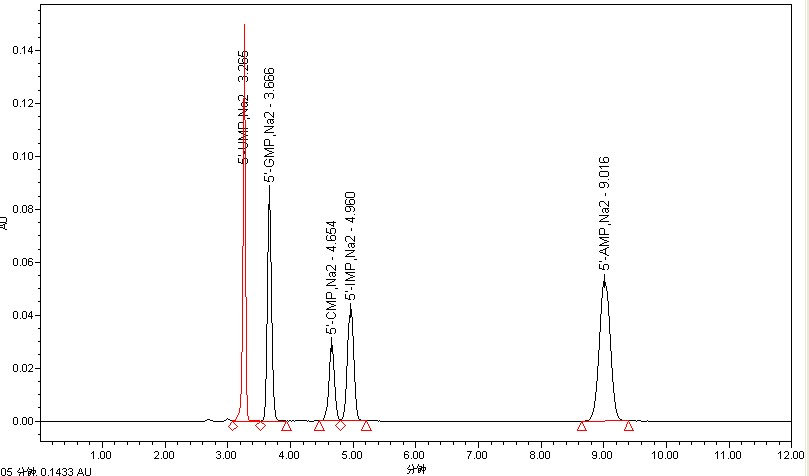
注:G:鸟嘌呤核苷(GMP);A:腺嘌呤核苷(AMP);I:次黄嘌呤核苷(IMP)
C:胞嘧啶核苷(CMP);U:尿嘧啶核苷(UMP)
九、保健食品中洛伐他汀的测定
1 范围
本方法规定了保健食品中洛伐他汀的液相色谱测定方法。
本方法适用于以红曲及其加工品为原料的保健食品中内酯(闭环)洛伐他汀及酸式(开环)洛伐他汀的测定。
2 原理
试样经75%乙醇溶液超声提取,采用液相色谱分离内酯(闭环)及酸式(开环)洛伐他汀,紫外检测器检测,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 无水乙醇(CH3CH2OH)。
3.1.3 磷酸(H3PO4)。
3.1.4 氢氧化钠(NaOH)。
3.1.5 盐酸(HCl):含量:36%~38%。
3.2 试剂配制
3.2.1 75%乙醇(v/v):将无水乙醇和水按75+25的体积比混合均匀。
3.2.2 0.2mol/L氢氧化钠溶液:称取氢氧化钠1.6g,加水使溶解成200mL,即得。
3.2.3 0.2mol/L盐酸溶液:吸取盐酸1.8mL,加水适量使成100mL,即得。
3.3 标准品
洛伐他汀标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 洛伐他汀标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.4 标准溶液配制
3.4.1 洛伐他汀标准储备液(400μg/mL):准确称取洛伐他汀标准品40mg(精确至0.01 mg),用75%乙醇溶解并定容至100mL。
3.4.2 洛伐他汀标准系列工作液:用流动相稀释,配制浓度为8.00μg/mL、20.0μg/mL、40.0μg/mL、80.0μg/mL、160μg/mL、320μg/mL 的系列标准工作液。
3.4.3 定性用酸式(开环)洛伐他汀溶液:称取洛伐他汀(内酯)标准品4mg,用0.2mol/L氢氧化钠溶液定容至100mL,在50℃条件下超声转化1h,冷却至室温后再放置1h,用0.2mol/L 盐酸溶液调节pH至中性。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列或紫外检测器(UV)。
4.2 分析天平:感量为0.01mg和0.0001g。
4.3 超声波清洗器,功率≥250W。
4.4 涡旋混合器。
4.5 离心机:转速≥3500 r/min。
5 分析步骤
5.1 试样制备
取片剂、颗粒剂等固体样品适量,研磨均匀;胶囊剂、软胶囊剂取内容物,研磨或混匀。称取上述混匀的试样适量(相当于含洛伐他汀约5mg),精密称定,置具塞锥形瓶中,精密加入50mL 75%乙醇,密塞,称定重量,超声提取(功率250W,频率33kHz)60min,放冷,再称定重量,用75%乙醇补足减失的重量,摇匀,以3500r/min的转速离心10min,取上清液,经0.45μm微孔滤膜过滤,滤液作为试样待测液。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250mm×4.6mm ,5μm或同等性能色谱柱。
5.2.2 柱温:25℃。
5.2.3 检测波长:238nm。
5.2.4 流动相:甲醇+水+磷酸=385+115+0.14。
5.2.5 流速:1.0mL/min。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液分别注入液相色谱仪中,测得相应的峰面积,以标准系列工作液的浓度(μg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样待测液注入液相色谱仪中,以保留时间定性,测定内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀峰面积,分别代入内酯型(闭环)洛伐他汀标准曲线计算,得到待测液中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的浓度(μg/mL)。
6 结果计算
6.1 试样中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的含量分别按下式计算: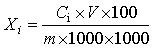
Xi—试样中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的含量,单位为克每百克(g/100g);
Ci—被测定样液中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的浓度,单位为微克每毫升(μg/mL);
V—被测定样液的最终定容体积,单位为毫升(mL);
m—试样的称样质量,单位为克(g);
100—单位转换;
1000—单位转换。
6.2 试样中洛伐他汀的总含量按下式计算:
X—试样中洛伐他汀的总含量,单位为克每百克(g/100g);
X1—试样中内酯型(闭环)洛伐他汀的含量,单位为克每百克(g/100g);
X2—试样中酸式(开环)洛伐他汀的含量,单位为克每百克(g/100g);
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图


十、保健食品中槲皮素、山柰素、异鼠李素的测定
1 范围
本方法规定了保健食品中槲皮素、山柰素、异鼠李素的液相色谱测定方法。
本方法适用于以银杏叶或银杏叶提取物为主要原料的保健食品中槲皮素、山柰素、异鼠李素的测定。
2 原理
试样经甲醇提取、酸水解等前处理后,采用液相色谱分离、紫外检测器检测,以保留时间定性,以外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 磷酸(H3PO4)。
3.1.3 盐酸(HCl):含量:36%~38%。
3.2 试剂配制
3.2.1 盐酸溶液(3.0mol/L):取盐酸25mL,加水适量使成100mL,摇匀。
3.2.2 80%甲醇溶液:将甲醇和水按80+20的体积比混合均匀。
3.3 标准品
槲皮素、山柰素、异鼠李素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.4 标准溶液配制
3.4.1 标准储备液(1mg/mL):分别准确称取槲皮素、山柰素、异鼠李素标准品100mg(准确至0.1mg),于100mL容量瓶中,用甲醇溶解并定容至刻度。
3.4.2 槲皮素、山柰素、异鼠李素混合标准中间液(200μg/mL):分别准确吸取槲皮素、山柰素、异鼠李素标准储备液各5.00mL于25mL容量瓶中,用流动相定容。
3.4.3 混合标准系列工作液:分别准确吸取槲皮素、山柰素、异鼠李素混合标准中间液0.50mL、1.00mL、2.00mL、3.00mL和5.00mL于10mL容量瓶中,用流动相定容至刻度,配制成质量浓度分别为10.0μg/mL、20.0μg/mL、40.0μg/mL、60.0μg/mL、100μg/mL的混合标准系列工作液。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列或紫外检测器(UV)。
4.2 分析天平:感量为0.01mg和0.0001g。
4.3 超声波清洗器:功率≥250W。
4.4 水浴锅。
5 分析步骤
5.1 试样制备
取片剂、颗粒剂等固体样品适量,研磨均匀;胶囊剂、软胶囊剂取内容物,研磨混匀。
5.1.1 槲皮素、山柰素、异鼠李素的测定
精密称取试样适量(相当于含槲皮素、山柰素、异鼠李素总量约3mg),加20mL甲醇,超声提取(功率250W,频率33kHz)30min,滤过,残渣用甲醇约5mL洗涤,洗液并入滤液,加入15mL盐酸溶液(3.0mol/L),水浴回流水解3h,冷却,转移至50mL容量瓶中,用甲醇定容至刻度,混匀,经0.45μm微孔滤膜过滤,取续滤液,作为试样待测液。
5.1.2 游离槲皮素、山柰素、异鼠李素的测定
精密称取试样适量(相当于含槲皮素、山柰素、异鼠李素总量约3mg),置具塞锥形瓶中,精密加入80%甲醇溶液20mL,密塞,称定重量,超声提取(功率250W,频率33kHz)20min,取出,放冷,再称定重量,用80%甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,作为试样待测液。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 150mm ×3.9mm ,5μm,或同等性能色谱柱。
5.2.2 柱温:25℃。
5.2.3 检测波长:360nm。
5.2.4 流动相:甲醇+0.4%磷酸溶液=50+50。
5.2.5 流速:1.0mL/min。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将10μL的混合标准系列工作液分别注入液相色谱仪中,测得相应的峰面积,以标准工作液的浓度(μg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将10μL试样待测液(5.1.1)注入液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线得到待测液中槲皮素、山柰素、异鼠李素的浓度(μg/mL);将10μL试样待测液(5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线得到待测液中游离槲皮素、山柰素、异鼠李素的浓度(μg/mL)。
6 结果计算
6.1 试样中槲皮素、山柰素、异鼠李素的含量分别按下式计算: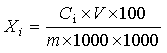
Xi—试样中槲皮素或山柰素或异鼠李素的含量,单位为克每百克(g/100g);
Ci—被测定样液中槲皮素或山柰素或异鼠李素的浓度,单位为微克每毫升(μg/mL);
V—被测定样液的最终定容体积,单位为毫升(mL);
m—试样的称样质量,单位为克(g);
100—单位转换;
1000—单位转换。
6.2 试样中槲皮素、山柰素、异鼠李素的总含量按下式计算: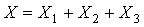
X—试样中槲皮素、山柰素、异鼠李素的总含量,单位为克每百克(g/100g);
X1—试样中槲皮素的含量,单位为克每百克(g/100g);
X2—试样中山柰素的含量,单位为克每百克(g/100g);
X3—试样中异鼠李素的含量,单位为克每百克(g/100g);
6.3 试样中银杏叶总黄酮醇苷的含量按下式计算: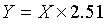
Y—试样中银杏叶总黄酮醇苷的含量,单位为克每百克(g/100g);
X—试样中槲皮素、山柰素、异鼠李素的总含量,单位为克每百克(g/100g);
2.51—换算因子。
6.4 试样中游离槲皮素、山柰素、异鼠李素的含量分别按下式计算: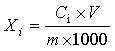
Xi—试样中游离槲皮素或游离山柰素或游离异鼠李素的含量,单位为毫克每克(mg/g);
Ci—被测定样液中游离槲皮素或游离山柰素或游离异鼠李素的浓度,单位为微克每毫升(μg/mL);
V—被测定样液的最终定容体积,单位为毫升(mL);
m—试样的称样质量,单位为克(g);
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
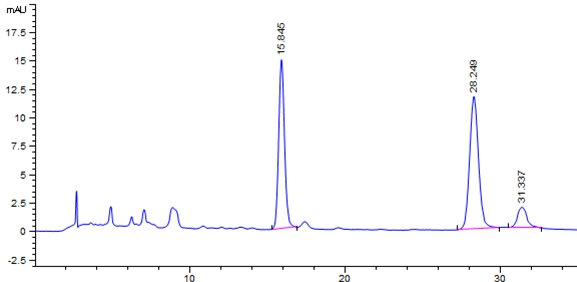
附录A
标准溶液和试样溶液典型液相色谱图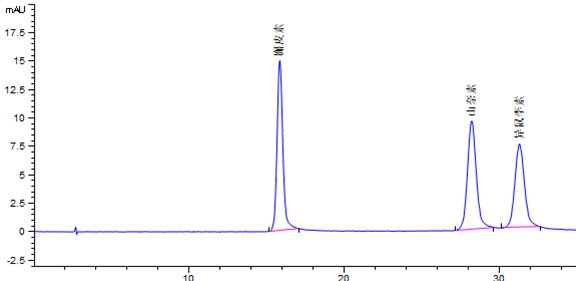
十一、保健食品中茶氨酸的测定
1 范围
本方法规定了保健食品中茶氨酸的高效液相色谱测定方法。
本方法适用于红茶、绿茶等及以茶氨酸为主要原料的保健食品中茶氨酸含量的测定。
2 原理
试样经水提取,使用等度洗脱,采用配有二极管阵列检测器或紫外检测器的高效液相色谱仪检测,以保留时间定性,外标法定量。
3 试剂和材料
注:水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 三氟乙酸(CF3COOH),色谱纯。
3.2 标准品
茶氨酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 茶氨酸标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 茶氨酸标准储备液:称取35.0mg茶氨酸标准品(精确到0.1mg),用水溶解后,移入10mL容量瓶,用水定容至刻度,此溶液浓度为3.5mg/mL。贮存于4℃冰箱中,有效期3个月。
3.3.2 茶氨酸标准系列工作液:分别准确吸取茶氨酸标准储备液(3.3.1)0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,移入10mL容量瓶,用水定容至刻度。得到浓度分别为0.070mg/mL、0.14mg/mL、0.21mg/mL、0.28mg/mL、0.35mg/mL茶氨酸标准使用液。临用时配制。
3.4 三氟乙酸水溶液:取水加三氟乙酸(3.1.1),调至pH3.0,经微孔滤膜(3.5)过滤,待用。
3.5 微孔滤膜:0.45µm,水相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 恒温水浴锅。
4.3 离心机:转速≥8000r/min。
4.4 分析天平:感量分别为0.0001g和0.001g。
4.5 pH计。
5 分析步骤
5.1 试样制备
5.1.1 固体试样的处理:称取粉碎试样适量(精确至0.001g,相当于含茶氨酸10mg),加水30mL,在80℃的恒温水浴锅上加热40min,冷却,离心,过滤后,转移至50mL容量瓶,用水定容至刻度,混匀。试样溶液经微孔滤膜(3.5)过滤,滤液进液相色谱仪分析。
5.1.2 液体试样的处理:取一定量的试样在水浴锅上蒸干,残渣用水溶解,转移至10mL容量瓶,用水定容至刻度,混匀。试样溶液经微孔滤膜(3.5)过滤,滤液进液相色谱仪分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm ,5μm,或性能相当者。
5.2.2 流动相:三氟乙酸水溶液(3.4)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:35℃。
5.2.5 检测波长:203nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的茶氨酸标准溶液的色谱峰面积(峰高),以标准工作液的浓度为横坐标,以色谱峰的峰面积(峰高)为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液茶氨酸的色谱峰面积(峰高),根据标准曲线得到待测液中茶氨酸的浓度,平行测定次数不少于两次。
茶氨酸的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中茶氨酸含量按下式计算: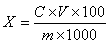
X—试样中茶氨酸的含量,单位为克每百克(g/100g);
C—由标准曲线得出的样液中茶氨酸的浓度,单位为毫克每毫升(mg/mL);
V—试样提取过程中定容体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
茶氨酸的高效液相色谱图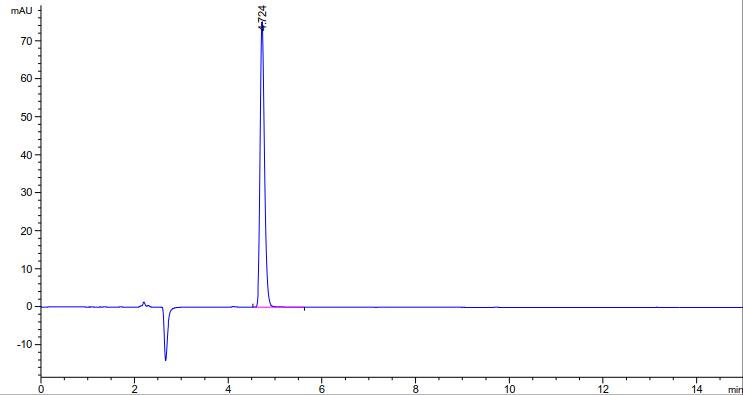
十二、保健食品中五味子醇甲、五味子甲素和乙素的测定
1 范围
本方法规定了保健食品中五味子醇甲、五味子甲素和乙素的高效液相色谱测定方法。
本方法适用于以北五味子为主要原料生产的保健食品中五味子醇甲、五味子甲素和乙素含量的测定。
2 原理
将试样中的五味子醇甲、五味子甲素和乙素经甲醇提取后,使用等度洗脱反相高效液相色谱进行分离,二极管阵列检测器检测,根据色谱峰的保留时间和紫外光谱图定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 甲醇(CH3OH)。
3.2 标准品
五味子醇甲、五味子甲素和乙素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 五味子醇甲、五味子甲素和乙素标准样品的中文名称、英文名称、CAS登录号、分子式相对分子量
3.3 标准溶液配制
3.3.1 五味子醇甲、五味子甲素和乙素混合标准储备液:分别准确称取五味子醇甲、五味子甲素和乙素标准样品(3.2)20mg(精确至0.01mg),用甲醇溶解,并转移至10mL容量瓶中,定容至刻度,溶液浓度分别为2mg/mL。
3.3.2 五味子醇甲、五味子甲素和乙素混合标准系列工作液:分别准确吸取不同体积的混合标准储备液(3.3.1),用甲醇将其稀释成含量分别为0.020mg/mL、0.050mg/mL、0.20mg/mL、0.50mg/mL、1.0mg/mL的标准系列工作液。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器。
4.2 超声波清洗器。
4.3 分析天平:感量分别为0.01mg和0.001g。
5 分析步骤
5.1 试样制备
准确称取粉碎后样品适量(相当于含五味子总量30mg,精确至0.001g),置20mL容量瓶中,加入甲醇(3.1.2)约18mL,超声提取20min,取出,静置待冷,加甲醇至刻度。试样溶液过0.45μm有机系滤膜,滤液进行液相色谱分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250mm×4.6mm,5μm,或同等性能色谱柱。
5.2.2 检测波长:254nm。
5.2.3 流动相:甲醇(3.1.1)+水,(77+23,v/v)。
5.2.4 流速:1.0mL/min。
5.2.5 柱温:35℃。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制五味子醇甲、五味子甲素和乙素的标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,以保留时间和紫外光谱图定性,用相应样品溶液五味子醇甲、五味子甲素和乙素的色谱峰面积,根据标准曲线得到待测液中五味子醇甲、五味子甲素和乙素的浓度,平行测定次数不少于两次。
五味子醇甲、五味子甲素和乙素的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中五味子醇甲、五味子甲素和乙素的含量按下式计算: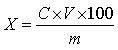
X—试样中五味子醇甲、五味子甲素和乙素的含量,单位为毫克每一百克(mg/100g);
C—试样溶液中五味子醇甲、五味子甲素和乙素的浓度,单位为毫克每毫升(mg/mL);
V—试样定容体积,单位为毫升(mL);
m—试样质量,单位为克(g)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
五味子醇甲、五味子甲素和乙素的高效液相色谱图
注:1为五味子醇甲;2为五味子甲素;3为五味子乙素
十三、保健食品中腺苷的测定
1 范围
本方法规定了保健食品中腺苷的高效液相色谱测定方法。
本方法适用于保健食品中腺苷的含量测定。
2 原理
试样经水超声提取,用高效液相色谱仪进行测定,以保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 磷酸二氢钾(KH2PO4)。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 硅藻土(SiO2):化学纯,粒径范围:0.2-0.8mm。
3.2 标准品
腺苷标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1腺苷标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 腺苷标准储备液:称取10mg (准确至0.01mg)腺苷标准品(3.2)于10mL 容量瓶中,用水溶解并定容至刻度,摇匀。此溶液浓度为1.0mg/mL。
3.3.2 腺苷标准中间液:准确吸取腺苷标准储备液(3.3.1)2.5mL于25mL容量瓶中,用水稀释至刻度,摇匀。此溶液浓度为100μg/mL。
3.3.3 腺苷标准系列工作液:分别准确吸取腺苷标准中间液(3.3.2)0.1mL、0.2mL、0.5mL、1.0mL、2.0mL、5.0mL于10mL容量瓶中,用水稀释至刻度,摇匀,得浓度分别为1.0μg/mL、2.0μg/mL、5.0μg/mL、10μg/mL、20μg/mL、50μg/mL的标准系列工作液。临用时配制。
3.4 磷酸二氢钾溶液(0.01mol/L):称取1.36g磷酸二氢钾(3.1.1),加水溶解并稀释至1000mL,经微孔滤膜(3.5)过滤,待用。
3.5 微孔滤膜:0.45µm,水相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 超声波提取器:功率250W,频率33kHz。
4.3 分析天平:感量0.01mg、0.0001g和0.001g。
4.4 离心机:转速≥3000 r/min。
5 分析步骤
5.1 试样制备
5.1.1 试样提取
5.1.1.1 固体试样
准确称取粉碎并混合均匀的试样0.5g~2g(精确至0.0001g,含待测组分约0.05mg ~2.5mg)于50mL容量瓶中,加入水约30mL,超声提取20min,放至室温,用水稀释至刻度,摇匀,以3000 r/min离心5min。再经微孔滤膜(3.5)过滤,取续滤液进液相色谱仪分析。
5.1.1.2 软胶囊试样
取软胶囊剪开,挤出内容物并混匀,准确称取2g(精确至0.0001g),准确加入等量硅藻土(3.1.3),研至分散均匀,准确称取其中部分(准确至0.0001g,含待测组分约0.05mg ~2.5mg),转移至250mL具塞三角瓶中,并吸取50.0mL水,并入三角瓶中,称重(准确至0.001g),加塞超声提取20min,放至室温,用水补足重量,摇匀,静置澄清或以3000r/min离心5min。取上清液,再经微孔滤膜(3.5)过滤,取续滤液进液相色谱仪分析。
5.1.1.3 液体试样
准确吸取混匀的试样5.0mL~10.0mL(含待测组分约0.05mg ~2.5mg)于50mL容量瓶中,加入水约30mL,超声提取20min,放至室温,用水稀释至刻度,摇匀,以3000r/min离心5min。再经微孔滤膜(3.5)过滤,取续滤液进液相色谱仪分析。
5.1.2 试样溶液稀释
必要时,根据上述试样溶液中腺苷的含量,用水进行适当的稀释(稀释倍数F),使待测溶液中腺苷浓度在1.0μg/mL~50μg/mL范围内。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm ,5μm,或性能相当者。
5.2.2 流动相:甲醇(3.1.2)+磷酸二氢钾溶液(3.4),(10+90,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:35℃。
5.2.5 检测波长:254nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.3)分别按液相色谱参考条件(5.2)进行测定,得到相应的腺苷标准溶液的色谱峰面积,以标准系列工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将待测溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的待测溶液腺苷的色谱峰面积,根据标准曲线得到待测液中腺苷的浓度,平行测定次数不少于两次。
腺苷的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中腺苷含量按下式计算: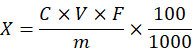
X—试样中腺苷的含量,固体和软胶囊试样的单位为毫克每百克(mg/100g),液体试样的单位为毫克每百毫升(mg/100mL);
C—根据标准曲线计算得到的待测溶液中腺苷的浓度,单位为微克每毫升(μg/mL);
V—试样提取时的定容体积,单位为毫升(mL);
F—稀释倍数;
m—试样称取的质量,单位为克(g);或液体试样吸取的体积,单位为毫升(mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录A
腺苷的高效液相色谱图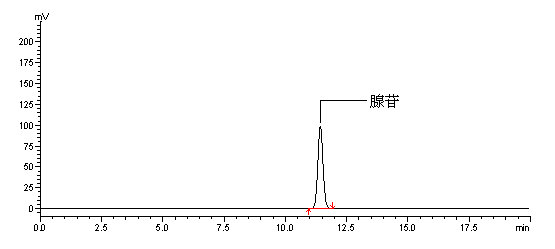
十四、保健食品中总皂苷的测定
1 范围
本方法规定了保健食品中总皂苷的分光光度测定方法。
本方法适用于含五加科原料保健食品中总皂苷含量的测定。
第一法
2 原理
试样用水提取总皂苷类成分,过大孔树脂柱除杂后,试样中的皂苷类成分在高氯酸的作用下与香草醛反应,产生特征的紫红色,采用分光光度法测定560nm波长处的吸光度,进行定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682 规定的一级水。
3.1 试剂
3.1.1 Amberlite-XAD-2 大孔树脂(或D-101大孔树脂):20~60目,使用前应按照使用说明书进行活化处理。
3.1.2 中性氧化铝:层析用(100-200目)。
3.1.3 无水乙醇(CH3CH2OH)。
3.1.4 甲醇(CH3OH)。
3.1.5 高氯酸(HClO4)。
3.1.6 冰乙酸(CH3COOH)。
3.1.7 香草醛(C8H8O3)。
3.2 标准品
人参皂苷Re标准样品的分子式、相对分子量、CAS登录号见表1,或经国家认证并授予标准物质证书的标准物质。
表1 人参皂苷Re标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
人参皂苷Re标准储备液(0.2mg/mL):准确称取人参皂苷Re标准样品(3.2)10mg(精确至0.01mg)于50mL容量瓶中,用甲醇溶解并定容至刻度,摇匀。
3.4 试剂配制
3.4.1 70%乙醇:取无水乙醇70mL,加水使成100mL,混匀。
3.4.2 香草醛溶液:称取5g香草醛,加冰乙酸溶解并定容至100mL,混匀。
4 仪器和设备
4.1 紫外/可见分光光度计。
4.2 天平:感量分别为0.01mg和0.001g。
4.3 超声波清洗器。
4.4 恒温水浴锅。
5 分析步骤
5.1 试样制备
5.1.1 试样处理
5.1.1.1 固体试样
称取已粉碎混合均匀的待测试样1g(精确至0.001g)(或根据试样含总皂苷量而定),置于具塞锥形瓶中,加入水100.0mL,称重,超声30min,放冷,再用水补足减失重量,摇匀,放置,滤过,续滤液备用。
5.1.1.2 液体试样
含乙醇的液体试样,吸取混合均匀的待测试样10.0mL(或根据试样含总皂苷量而定)置水浴上挥尽乙醇后,用水转移至10mL容量瓶中,并用水稀释至刻度,备用;非乙醇类的液体试样,直接取样。
5.1.2 柱层析法
在内径为1.5cm的玻璃层析柱内装3cm已活化的大孔树脂(3.1.1),上加1cm中性氧化铝(3.1.2)。先用25mL70%乙醇(3.4.1)洗柱,弃去洗脱液,再用约25mL水洗脱至无醇味,弃去洗脱液,加入1.0mL已处理好的试样溶液(5.1.1),用25mL水洗脱,弃去洗脱液,再用25mL 70%乙醇(3.4.1)以不超过3mL/min的速度洗脱人参皂苷至洗脱液无色,收集洗脱液于蒸发皿中,置于60℃水浴挥干,残渣用少量甲醇(3.1.4)溶解并转移至10mL具塞比色管中,备用。
5.2 标准曲线的制作
吸取人参皂苷Re标准溶液(3.3)0.0mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL于10mL具塞比色管中,置水浴中挥干溶剂,加入0.2mL香草醛溶液(3.4.2),再加入0.8mL高氯酸(3.1.5),混匀,使残渣全部溶解,置60℃水浴中加热10min,取出,冰浴冷却后,加入5.0mL冰乙酸(3.1.6),摇匀后,以相应试剂为空白,立即于560nm波长处测定吸光度。
5.3 试样溶液的测定
取5.1.2项下备用溶液 ,从5.2置水浴中挥干溶剂……”起,与标准溶液同法测定吸光度。
6 结果计算
试样中总皂苷含量(以人参皂苷Re计)按下式计算: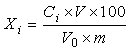
Xi—试样中总皂苷的含量(以人参皂苷Re计),单位为毫克每百克(mg/100g)或毫克每百毫升(mg/100mL);
Ci—由标准曲线算得被测液中人参皂苷Re质量,单位为毫克(mg) ;
V—被测样品的稀释体积,单位为毫升(mL);
V0—用于柱层析的样液体积,单位为毫升(mL);
m—试样取样量,单位为克(g)或毫升(mL);
100—单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10% 。
第二法
8 原理
试样用水提取总皂苷类成分,经水饱和正丁醇萃取除杂后,试样中的皂苷类成分在高氯酸的作用下与香草醛反应,产生特征的紫红色,采用分光光度法测定560nm波长处的吸光度,进行定量。
9 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682 规定的一级水。
9.1 试剂
9.1.1 甲醇(CH3OH)。
9.1.2 石油醚:沸程(60~90℃)。
9.1.3 正丁醇(CH3(CH2)2CH2OH)。
9.1.4 无水乙醇(CH3CH2OH)。
9.1.5 氨水(NH3.H2O)。
9.1.6 高氯酸(HClO4)。
9.1.7 冰乙酸 (CH3COOH)。
9.1.8 香草醛(C8H8O3)。
9.2 标准品
人参皂苷Re标准样品:同3.2。
9.3 标准溶液配制
人参皂苷Re标准储备液(0.2 mg/mL):同3.3。
9.4 试剂配制
9.4.1 香草醛溶液:同3.4.2。
9.4.2 水饱和正丁醇溶液:取正丁醇适量,加入适量水,充分振摇,静置使分层,上层液体即为水饱和正丁醇。
9.4.3 氨试液:取氨水40mL,加水使成100mL,混匀。
10 仪器和设备
10.1 紫外/可见分光光度计。
10.2 天平:感量为0.01mg和0.001g。
10.3 超声波清洗器。
10.4 离心机:转速 ≥4000r/min。
10.5 恒温水浴锅。
11 分析步骤
11.1 试样制备
11.1.1 试样处理
11.1.1.1 固体试样
称取已粉碎混合均匀的待测试样1g(精确至0.001g)(或根据试样含总皂苷量定),置于具塞锥形瓶中,加入水100.0mL,称重,超声30min,放冷,再用水补足减失重量,摇匀,放置,滤过,续滤液备用。
11.1.1.2 液体试样
含乙醇的液体试样,吸取混合均匀的待测试样10.0mL(或根据试样含总皂苷量而定)置水浴上挥尽乙醇后,用水转移至10mL容量瓶中,并用水稀释至刻度,备用;非乙醇类的液体试样,直接取样。
11.1.1.3 含油基质试样
称取已混合均匀的待测试样0.5g(或根据试样含总皂苷量而定)置于100mL离心管中,加入20mL石油醚(9.1.2),涡旋混合1min,4000r/min离心5min,弃去上清液,残渣挥干石油醚后,加入水50.0mL,称重,超声30min,放冷,再用水补足减失重量,摇匀,放置,滤过,续滤液备用。
11.1.2 萃取除杂
取11.1.1.1、11.1.1.3项下备用溶液25.0mL置分液漏斗中;或将11.1.1.2项下备用溶液用水全部转移至分液漏斗中(非乙醇类液体试样直接取10.0mL)并加水至约25mL。加入20mL水饱和正丁醇(9.4.2)振摇萃取,分取正丁醇液(必要时可离心),重复操作3次,合并正丁醇液用20mL氨试液(9.4.3)洗涤,重复操作2次,弃去氨试液,以适宜方式(水浴、减压或氮吹)除去正丁醇液后,残渣用甲醇(9.1.1)溶解并转移至25mL量瓶中(液体样品则转移至10mL量瓶中),加甲醇定容至刻度,摇匀,滤过,取续滤液,备用。
11.2 标准曲线的制作
吸取人参皂苷Re标准溶液(9.3)0.0mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL于10mL具塞比色管中,置水浴中挥干溶剂,加入0.2mL香草醛溶液(9.4.1),再加入0.8mL高氯酸(9.1.6),混匀,使残渣全部溶解,置60℃水浴中加热10min,取出,冰浴冷却后,加入5.0mL冰乙酸(9.1.7),摇匀后,以相应试剂为空白,立即于560nm波长处测定吸光度。
11.3 试样溶液的测定
取11.1.2项下备用溶液1.0mL于10mL具塞比色管中,从11.2 “置水浴中挥干溶剂……”起,与标准溶液同法测定吸光度。
11.4 背景校正(如样品不存在背景干扰,无需校正)
吸取11.1.2项下备用溶液1.0mL于10mL具塞比色管中,置水浴中挥干溶剂,加入0.2mL冰乙酸(9.1.7),从11.2 “再精密加入0.8 mL高氯酸(9.1.6)……”起,与试样同法测定吸光度,做试样背景校正。
12 结果计算
试样中总皂苷含量(以人参皂苷Re计)按下式计算: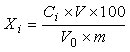
Xi—试样中总皂苷的含量(以人参皂苷Re计),单位为毫克每百克(mg/100g)或毫克每百毫升(mg/100mL);
Ci—经试样背景校正后,由标准曲线算得被测液中人参皂苷Re质量,单位为毫克(mg) ;
V—被测样品的稀释体积,单位为毫升(mL);
V0—用于显色的样液体积,单位为毫升(mL);
m—试样取样量,单位为克(g)或毫升(mL);
100—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
13 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10% 。
十五、保健食品中总黄酮的测定
1 范围
本方法规定了保健食品中总黄酮的分光光度测定方法。
本方法适用于以含黄酮类成分为主要原料的保健食品中总黄酮含量的测定。
第一法
2 原理
试样中的总黄酮经乙醇提取、聚酰胺粉吸附、甲苯和甲醇洗脱净化后,以芦丁为对照样品,采用分光光度法在360nm波长下测定总黄酮的吸光度,标准曲线法进行定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水或三级水。
3.1 试剂
3.1.1乙醇(C2H5OH)。
3.1.2聚酰胺粉。
3.1.3甲苯(C7H8)。
3.1.4甲醇(CH3OH)。
3.2 标准品
芦丁标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥90%,或经国家认证并授予标准物质证书的标准物质。
表1 芦丁标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1芦丁标准储备液:称取在102℃烘箱中恒重后的芦丁标准样品(3.2)5.0mg(精确至0.01mg),加甲醇溶解,并转移至100mL容量瓶中定容至刻度,此溶液浓度为50μg/mL。
3.3.2芦丁标准系列工作液:精密吸取0.0、1.0、2.0、3.0、4.0、5.0mL的标准储备液(3.3.1),分别置于10mL容量瓶中,加甲醇至刻度,摇匀,制成芦丁浓度分别为0.0μg/mL、5.0μg/mL、10μg/mL、15μg/mL、20μg/mL、25μg/mL的标准系列工作液。
4 仪器和设备
4.1 紫外/可见分光光度计。
4.2 超声波清洗器。
4.3 层析柱。
4.4 分析天平:感量分别为0.01mg、0.0001g和0.001g。
5 分析步骤
5.1 试样制备
称取一定量的试样,加乙醇(3.1.1)定容至25mL,摇匀,超声提取20min,放置,吸取上清液1.0mL,于蒸发皿中,加1g聚酰胺粉(3.1.2)吸附,水浴挥去乙醇,然后转入层析柱(层析柱内径可根据每个产品具体情况确定)。先用20mL甲苯(3.1.3)洗脱,弃去甲苯液;然后用甲醇(3.1.4)洗脱,合并洗脱液并定容至25mL,即得。
5.2 标准曲线的制作
取标准系列工作液(3.3.2),于波长360nm测定吸光度,以芦丁标准工作液的浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
5.3 试样溶液的测定
取试样溶液(5.1),于波长360nm测定吸光度,根据标准曲线得到试样溶液中总黄酮的浓度,平行测定次数不少于两次。
6 结果计算
试样中总黄酮含量按下式计算: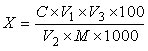
X—试样中总黄酮的含量,以芦丁(C27H30O16)计, 单位为克每一百克或克每一百毫升(g/100g或g/100mL);
C—试样溶液中总黄酮的浓度,单位为毫克每毫升(mg/mL);
V1—试样定容体积,单位为毫升(mL);
V2—吸取试样溶液体积,单位为毫升(mL);
V3—过柱后定容体积,单位为毫升(mL);
M—试样取样量,单位为克或毫升(g或mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
第二法
8 原理
试样经预处理除杂后,以甲醇或60%乙醇溶液提取黄酮类成分。试样中的黄酮类成分可被亚硝酸钠还原,与硝酸铝生成络合物,在氢氧化钠溶液碱性条件下开环,生成2-羟基查尔酮而使溶液显特征的橙红色,采用分光光度法在510nm波长处测定吸光度,以芦丁为对照品,采用标准曲线法计算样品中总黄酮的含量。
9 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水或三级水。
9.1 试剂
9.1.1 亚硝酸钠(NaNO2)。
9.1.2 硝酸铝(Al(NO3)3·9H2O)。
9.1.3 氢氧化钠(NaOH)。
9.1.4 石油醚(60~90℃)。
9.1.5 无水乙醇(CH3CH2OH)。
9.1.6 甲醇(CH3OH)。
9.2 试剂配制
9.2.1 5%亚硝酸钠溶液:称取5.0g亚硝酸钠(9.1.1),加水溶解成100mL。
9.2.2 10%硝酸铝溶液:称取硝酸铝(9.1.2)17.6g,加水溶解成100mL。
9.2.3 氢氧化钠试液:称取氢氧化钠(9.1.3)4.3g,加水溶解成100mL。
9.2.4 60%乙醇:量取无水乙醇(9.1.5)60mL,加水至100mL。
9.3 标准品
芦丁标准样品:同3.2。
9.4 标准溶液配制
9.4.1 芦丁标准储备液:准确称取在102℃烘箱中恒重后的芦丁标准样品(9.3)20mg(精确至0.01 mg),加甲醇溶解,并转移至100mL容量瓶中,定容至刻度,此溶液浓度为0.2mg/mL。
10 仪器和设备
10.1 紫外/可见分光光度计。
10.2 超声波清洗器。
10.3 离心机。
10.4 索氏提取器。
10.5分析天平:感量分别为0.01mg、0.0001g和0.001g。
11 分析步骤
11.1 试样制备
注:试样取样量、供试液取样体积可根据试样中总黄酮的含量适当调整,以保证测定的吸光度值在0.3~0.7范围内。
11.1.1 含油脂类固体样品与软胶囊:精密称取含油脂类固体样品或软胶囊内容物0.4g,置索氏提取器中,加石油醚(9.1.4)加热回流提取至提取液无色,弃去石油醚液,样渣挥去石油醚,转移至具塞锥形瓶中,精密加甲醇(9.1.6)25mL,密塞,称定重量,超声处理30min,放冷至室温,称定重量,用甲醇补足减失的重量,摇匀,离心,取上清液作为供试品溶液。
11.1.2 不含油脂类固体样品:精密称取适量,置于具塞锥形瓶中,精密加甲醇(9.1.6)25mL,密塞,称定重量,超声处理30min,放冷至室温,称定重量,用甲醇补足减失的重量,摇匀,离心,取上清液作为供试品溶液。
11.1.3 液体试样:精密吸取供试品2mL,置于25mL容量瓶中,加60%乙醇(9.2.4)溶解并稀释至刻度,摇匀,作为供试品溶液。
11.2 标准曲线的制作
精密吸取0.0、1.0、2.0、3.0、4.0、5.0、6.0mL的芦丁标准储备液(9.4.1),分别置于25mL容量瓶中,加水至6mL,加入5%亚硝酸钠溶液(9.2.1)1mL,摇匀,放置6min,加10%硝酸铝溶液(9.2.2)1mL,摇匀,放置6min,加氢氧化钠试液(9.2.3)10mL,摇匀,再加水至刻度,摇匀,放置15min,制成芦丁浓度分别为0.0μg/mL、 8.0μg/mL、16μg/mL、24μg/mL、32μg/mL、40μg/mL、48μg/mL的标准系列工作液。以0.0mL标准储备液制得的溶剂为空白,在波长510nm处分别测定吸光度值。以吸光度为纵坐标,对照品浓度为横坐标,绘制标准曲线。
11.3 试样溶液的测定
精密吸取供试品溶液(11.1)2mL,至25mL容量瓶中;照11.2,自加水至6mL起,……,至在510nm波长处测定吸光度,同法操作。从标准曲线上读出供试品溶液中含总黄酮的浓度,计算样品中总黄酮的含量。
12 结果计算
试样中总黄酮含量按下式计算: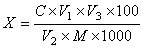
X—试样中总黄酮的含量,以芦丁(C27H30O16)计, 单位为克每一百克或克每一百毫升(g/100g或g/100mL);
C—标准曲线上读出供试品溶液中总黄酮的浓度,单位为毫克每毫升(mg/mL);
V1—试样定容体积,单位为毫升(mL);
V2—吸取试样溶液体积,单位为毫升(mL);
V3—显色定容体积,单位为毫升(mL);
M—试样取样量,单位为克或毫升(g或mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
13 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的:15%(固体样品)、10%(液体样品)。
注:样品有颜色时,可采用样品标准添加法,以0号管调零,绘制标准曲线,以消除样品颜色干扰。
十六、保健食品中壳聚糖脱乙酰度的测定
1 范围
本方法规定了保健食品中壳聚糖脱乙酰度的碱量法测定方法。
本方法适用于保健食品中壳聚糖脱乙酰度的测定。
2 原理
用盐酸溶液溶解试样,溶液中游离的H+用氢氧化钠标准滴定溶液滴定,以甲基橙-苯胺蓝作指示液,通过消耗的氢氧化钠的量计算试样中氨基的含量,从而得到试样中壳聚糖脱乙酰度。
3 试剂和材料
注:水为GB/T 6682规定的一级水。
3.1 试剂配制
3.1.1 盐酸标准滴定溶液:c(HCl)=0.1mol/L。按照GB/T 601标准要求配制和标定,也可购买市售商品化试剂。
3.1.2 氢氧化钠标准滴定溶液:c(NaOH)=0.1mol/L。按照GB/T 601标准要求配制和标定,也可购买市售商品化试剂。
3.1.3 甲基橙-苯胺蓝指示液:甲基橙溶液(1g/L)与苯胺蓝溶液(1g/L)以1:2体积比混合。
4 仪器和设备
分析天平:感量为0.0001g。
5 分析步骤
5.1 试样制备
准确称取于105℃±2℃烘干至恒重的试样0.2g,精确至0.0001g,加入30mL盐酸标准滴定溶液,搅拌至完全溶解,加入2滴~3滴甲基橙-苯胺指示液。
5.2 滴定
用氢氧化钠标准滴定溶液滴定5.1中得到的溶液,滴定使溶液颜色由紫红色变为蓝绿色为止,记录消耗氢氧化钠标准滴定溶液的体积。
6 结果计算
试样中壳聚糖脱乙酰度W按下式计算: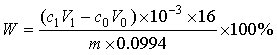
c 1—盐酸标准滴定溶液的浓度,单位为摩尔每升(mol/L);
V1—加入盐酸标准滴定溶液的体积,单位为毫升(mL);
c 0—氢氧化钠标准滴定溶液的浓度,单位为摩尔每升(mol/L);
V0—滴定用氢氧化钠标准滴定溶液的体积,单位为毫升(mL);
10-3—单位换算系数;
16—氨基的摩尔质量,单位为克每摩尔(g/mol);
m—试样中壳聚糖的质量,单位为克(g);
0.0994—理论氨基含量(16/161)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。
十七、保健食品中总蒽醌的测定
1 范围
本方法规定了保健食品中总蒽醌的分光光度测定方法。
本方法适用于保健食品中总蒽醌的测定。
2 原理
试样经酸水解后,以有机溶剂提取总蒽醌,利用羟基蒽醌衍生物在碱性溶液中显红-紫红色反应(Borntrager反应),采用分光光度法,以标准曲线定量检测。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的三级水。
3.1 试剂
3.1.1 盐酸(HCl):含量:36%~38%。
3.1.2 氨水(NH3·H2O)。
3.1.3 二氯甲烷(CH2Cl2)。
3.1.4 氢氧化钠(NaOH)。
3.1.5 甲醇(CH3OH)。
3.2 标准品
1,8-二羟基蒽醌标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99.0%,或经国家认证并授予标准物质证书的标准物质。
表1 1,8-二羟基蒽醌标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
1,8-二羟基蒽醌标准溶液:精密称取1,8-二羟基蒽醌标准样品10mg(精确至0.01mg),置25mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成0.4mg/mL的溶液。
3.4 试剂配制
3.4.1 4%氨溶液:取氨水16mL,加水稀释至100mL。
3.4.2 10%氢氧化钠溶液:称取氢氧化钠10g,加水溶解并定容至100mL。
3.4.3 混合碱溶液:等体积10%氢氧化钠溶液和4%氨溶液混合。
3.4.4 甲醇-盐酸(10:1)混合溶液:取甲醇100mL,加盐酸10mL,混合均匀。
4 仪器和设备
4.1 分光光度计
4.2 分析天平:感量分别为0.01mg和0.0001g。
4.3 恒温水浴锅
4.4 旋转蒸发仪
5 分析步骤
5.1 标准曲线的制作
分别精密吸取1,8-二羟基蒽醌标准溶液0.00mL、0.10mL、0.20mL、0.40mL、0.60mL、0.80mL、1.00mL于25mL容量瓶中,加混合碱溶液至刻度,混匀,于暗处放置30分钟。以混合碱溶液为空白,在525nm波长处,分别测定吸光度。以浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
5.2 试样溶液的测定
精密取混合均匀的待测试样适量(相当于含总蒽醌2mg~17mg),置100mL圆底烧瓶中,精密加入甲醇-盐酸(10:1)混合溶液25mL,称重,在80℃水浴中加热回流30分钟,放冷,用甲醇补足减失的重量,摇匀,滤过,弃去初滤液,精密量取续滤液15mL至分液漏斗中,加水25mL,用二氯甲烷萃取3次(50mL、40mL、30mL),合并提取液,并用水洗涤3次,每次40mL,洗涤至中性,弃去水洗液,二氯甲烷层转移至蒸发皿中水浴蒸干,或转移至圆底烧瓶于40℃水浴中减压蒸馏至干,残渣加甲醇使溶解并转移至10mL容量瓶中,用甲醇定容至刻度,摇匀。精密量取2mL,置25mL容量瓶中,加混合碱溶液至刻度,混匀,作为待测液。该溶液于暗处放置30分钟,以混合碱溶液为空白,在525nm波长处,测定吸光度(如果待测液浑浊,可过滤或离心后测定吸光度)。根据回归方程计算试样中总蒽醌的含量。
6 结果计算
试样中总蒽醌含量按下式计算:
V1×V3×V5×100
X= C×————————
V2×V4×m
式中:
X——试样中总蒽醌的含量,单位为毫克每百克(mg/100g);
C——由标准曲线查得测定试样中总蒽醌的浓度,单位为毫克每毫升(mg/mL);
V1——试样酸解时的稀释体积(mL);
V2——用二氯甲烷萃取时吸取的酸解液体积(mL);
V3——残渣溶解后的体积(mL);
V4——混合碱显色时吸取的甲醇溶液的体积(mL);
V5——混合碱显色的定容体积(mL);
m——试样的称样质量,单位为克(g);
100——单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
十八、保健食品中10-羟基-2-癸烯酸的测定
1 范围
本方法规定了保健食品中10-羟基-2-癸烯酸的高效液相色谱测定方法。
本方法适用于保健食品中10-羟基-2-癸烯酸的含量测定。
2 原理
试样经乙醇或甲醇提取后,用高效液相色谱进行测定,以保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。
3.1 试剂
3.1.1 磷酸(H3PO4)。
3.1.2 盐酸(HCl):含量:36%~38%。
3.1.3 甲醇(CH3OH):色谱纯。
3.1.4 无水乙醇(C2H6O)。
3.1.5 硅藻土(SiO2):化学纯,粒径范围:0.2~0.8mm。
3.2 标准品
10-羟基-2-癸烯酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 10-羟基-2-癸烯酸标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液的配制
3.3.1 10-羟基-2-癸烯酸标准储备液:称取10mg(准确至0.01mg)10-羟基-2-癸烯酸标准品(3.2)于10mL 容量瓶中,用无水乙醇(3.1.4)溶解并定容至刻度,摇匀。此溶液浓度为1.0 mg/mL。
3.3.2 10-羟基-2-癸烯酸标准系列工作液:分别准确吸取10-羟基-2-癸烯酸标准储备液(3.3.1)0.02mL、0.10mL、0.20mL、0.50mL、1.00mL 于 10.0mL容量瓶中,用无水乙醇(3.1.4)稀释至刻度,摇匀,得浓度分别为2.0μg/mL、10.0μg/mL、20.0μg/mL、50.0μg/mL、100μg/mL的标准系列工作液。
3.4 盐酸溶液(0.01mol/L):准确吸取盐酸(3.1.2)0.9mL,缓慢加入1000mL水,混匀。
3.5 微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
4.2 分析天平:感量分别为0.01mg、0.0001g和0.001g。
4.3 离心机:转速≥3000r/min。
4.4 超声波清洗器:功率250W,频率33kHz。
5 分析步骤
5.1 试样制备
5.1.1 试样提取
5.1.1.1 固体试样
准确称取粉碎并混合均匀的试样0.5g~2g(准确至0.0001g,含待测组分约0.1 mg ~5 mg)于50mL容量瓶中,吸取盐酸溶液(3.4)2.0mL,量取无水乙醇(3.1.4)30mL,超声提取20min,放至室温,用无水乙醇(3.1.4)稀释至刻度,摇匀,3000r/min离心10min。取上清液经0.45μm微孔滤膜(3.5)过滤后,取续滤液供液相色谱分析用。
5.1.1.2 软胶囊试样
取软胶囊剪开,挤出内容物并混匀,准确称取2g(准确至0.0001g)后,准确加入等量硅藻土(3.1.5),研至分散均匀,准确称取其中部分(准确至0.0001g,含待测组分约0.1mg~5mg),转移至250mL具塞三角瓶中,分别吸取盐酸溶液(3.4)2.0mL、无水乙醇(3.1.4)48 mL,并入三角瓶中,称重(准确至0.001g),加塞超声提取20min,放至室温,用无水乙醇(3.1.4)补足重量,摇匀,静置澄清或取部分混悬液3000r/min离心10min。取上清液经0.45μm微孔滤膜(3.5)过滤后,取续滤液供液相色谱分析用。
5.1.1.3 液体试样
准确吸取混匀的试样5.0mL~10.0mL(含待测组分约0.1mg ~5mg)于50mL容量瓶中,加甲醇(3.1.3)30mL,超声提取20min,放至室温,用甲醇(3.1.3)稀释至刻度,摇匀,3000r/min离心10min。取上清液经0.45μm微孔滤膜(3.5)过滤后,取续滤液供液相色谱分析用。
5.1.2 试样溶液稀释
必要时,根据试样溶液中10-羟基-2-癸烯酸的含量,用相应溶剂进行适当的稀释(稀释倍数F),使待测溶液中10-羟基-2-癸烯酸浓度在2.0μg/mL~100.0μg/mL范围内。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250mm×4.6mm,5μm,或性能相当者。
5.2.2 流动相:甲醇(3.1.3)+水+磷酸(3.1.1),(55+45+0.2,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:35℃。
5.2.5 检测波长:210nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将10-羟基-2-癸烯酸标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的色谱峰面积。以标准系列工作液的浓度为横坐标,以色谱峰面积为纵坐标,绘制标准曲线。
10-羟基-2-癸烯酸标准溶液液相色谱图参见附录A中图A.1。
5.4 待测溶液的测定
将待测溶液(5.1)按液相色谱参考条件(5.2)进行测定,以保留时间定性,得到待测溶液中10-羟基-2-癸烯酸的色谱峰面积,根据标准曲线计算待测溶液中10-羟基-2-癸烯酸的浓度,平行测定次数不少于两次。
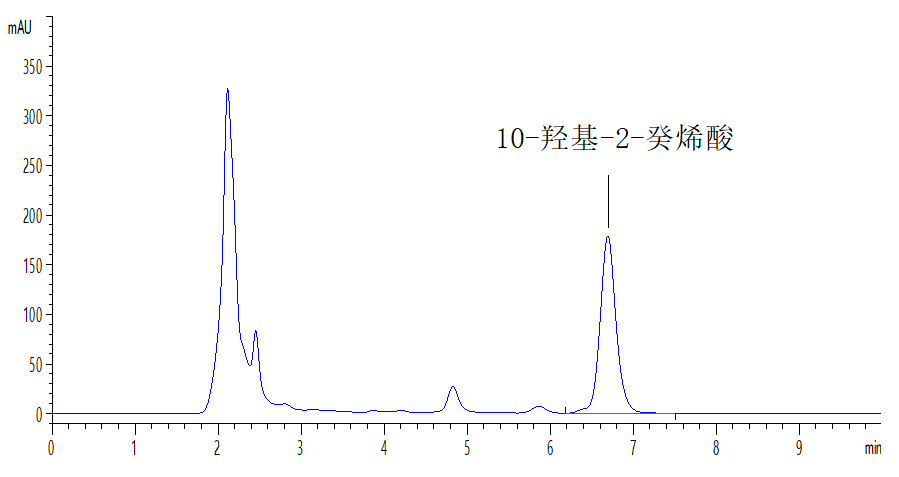
待测溶液液相色谱图参见附录A中图A.2。
6 结果计算
试样中10-羟基-2-癸烯酸含量按下式计算: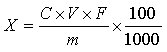
X—试样中10-羟基-2-癸烯酸的含量,固体和软胶囊试样单位为毫克每百克(mg/100g),液体试样为毫克每百毫升(mg/100mL);
C—根据标准曲线计算得到的待测溶液中10-羟基-2-癸烯酸的浓度,单位为微克每毫升(μg/mL);
V—试样提取时的定容体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);或液体试样吸取的体积,单位为毫升(mL);
F—稀释倍数;
100—单位换算;
1000—单位换算。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录 A
标准溶液和待测溶液典型高效液相色谱图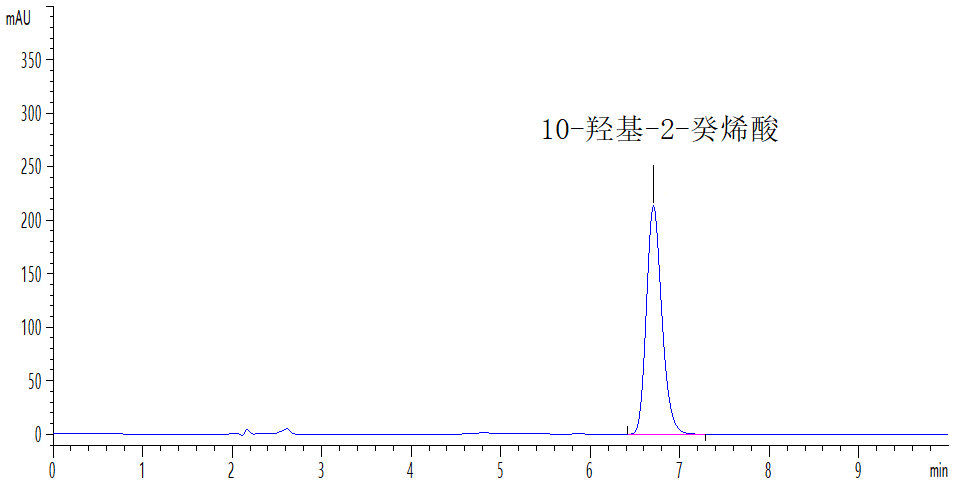
十九、保健食品中绞股蓝皂苷XL IX的测定
1 范围
本方法规定了保健食品中绞股蓝皂苷XL IX的高效液相色谱测定方法。
本方法适用于以绞股蓝及其加工品为主要原料的保健食品中绞股蓝皂苷XL IX含量的测定。
2 原理
试样经甲醇提取后,采用配有二极管阵列检测器或紫外检测器的高效液相色谱仪检测,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。
3.1 试剂
3.1.1 乙腈(CH3CN):色谱纯。
3.1.2 甲醇(CH3OH):分析纯。
3.2 标准品
绞股蓝皂苷XL IX标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99%,或经国家认证并授予标准物质证书的标准物质。
表1 绞股蓝皂苷XL IX标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 绞股蓝皂苷XL IX标准储备液:称取在60±5℃,40kpa~53kpa条件下减压干燥3h的绞股蓝皂苷XL IX标准样品(3.2)0.025g(精确至0.0001g),用甲醇(3.1.2)溶解,并转移至5mL容量瓶中,定容至刻度,此溶液浓度为5mg/mL。贮存于-18℃冰箱中,有效期3个月。
3.3.2 绞股蓝皂苷XL IX标准系列工作液:分别准确吸取不同体积的标准储备液(3.3.1),用甲醇将其稀释成绞股蓝皂苷XL IX含量分别为0.005mg/mL、0.01mg/mL、0.02mg/mL、0.10mg/mL、0.50mg/mL的标准系列工作液。也可依仪器响应情况配制适当浓度的标准工作溶液。标准工作溶液需临用时配制。
3.4微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 超声波清洗器。
4.3 分析天平:感量分别为0.0001g和0.001g。
5 分析步骤
5.1 试样制备
5.1.1固体试样
取20粒以上片剂或胶囊试样进行粉碎、混匀,或取半固态试样混匀(软胶囊称取内容物),准确称取0.5g试样(精确至0.001g)于10mL具塞刻度试管中,加入甲醇8mL,混匀,超声5min后,冷却至室温,用甲醇定容至刻度,混匀,经微孔滤膜(3.4)过滤,取续滤液进液相色谱仪分析。
5.1.2 液体试样
准确称取摇匀的试样0.5mL于10mL容量瓶中,加入甲醇8mL,混匀,超声5min后,冷却至室温,用甲醇定容至刻度,混匀,经微孔滤膜(3.4)过滤,取续滤液进液相色谱仪分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,100mm×4.6mm,3μm,或性能相当者。
5.2.2 流动相A:乙腈(3.1.1),流动相B:水,梯度洗脱条件见表2。
表2 梯度洗脱条件
5.2.3 流速:0.5mL/min。
5.2.4 柱温:40℃。
5.2.5 检测波长:203nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的绞股蓝皂苷XL IX标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的待测溶液绞股蓝皂苷XL IX的色谱峰面积,根据标准曲线得到待测液中绞股蓝皂苷XL IX的浓度,平行测定次数不少于两次。
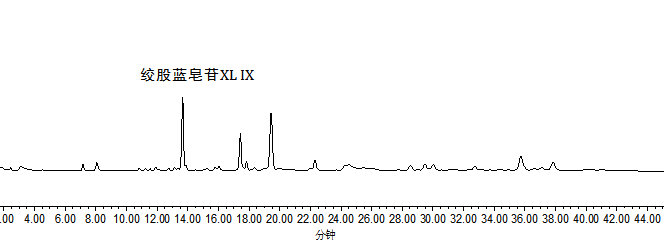
绞股蓝皂苷XL IX的标准溶液液相色谱图参见附录A的图A.1。
绞股蓝皂苷XL IX的试样溶液液相色谱图参见附录A的图A.2。
6 结果计算
试样中绞股蓝皂苷XL IX含量按下式计算:
X—试样中绞股蓝皂苷XL IX的含量,单位为克每百克(g/100g)或克每百毫升(g/100mL);
C—由标准曲线得出的样液中绞股蓝皂苷XL IX的浓度,单位为毫克每毫升(mg/mL);
V—试样提取过程中定容体积,单位为毫升(mL);
m—试样称取的质量或量取的体积,单位为克(g)或毫升(mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图
二十、保健食品中总三萜的测定
1 范围
本方法规定了保健食品中总三萜的紫外-可见分光光度测定方法。
本方法适用于以含有三萜类成分为主要原料的保健食品中总三萜含量的测定。
2 原理
试样用氯仿或乙酸乙酯提取出的三萜类物质,在高氯酸的作用下与香草醛反应产生有色物质。以熊果酸为对照品,采用分光光度法测定总三萜在548nm波长下的吸光度进行定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯。
3.1 试剂
3.1.1 乙酸乙酯(CH3COOCH2CH3)。
3.1.2 氯仿(CHCl3)。
3.1.3 冰乙酸(CH3COOH)。
3.1.4 高氯酸(HClO4)。
3.1.5 香草醛(C8H8O3)。
3.2 标准品
熊果酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥90%,或经国家认证并授予标准物质证书的标准物质。
表1 熊果酸标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
熊果酸标准品溶液(100μg/mL):精密称取熊果酸标准样品(3.2)10mg,至100mL容量瓶中,加乙酸乙酯(3.1.1)溶解并稀释至刻度,摇匀。
3.4 试剂配制
香草醛冰乙酸溶液(5%):精密称取香草醛(3.1.5)0.5g,加冰乙酸(3.1.3)使溶解成10mL,即得。临用前配制。
4 仪器和设备
4.1 紫外-可见分光光度计。
4.2 分析天平:感量分别为0.01mg和0.0001g。
4.3 恒温水浴锅。
4.4 超声波清洗器。
4.5 离心机。
5 分析步骤
5.1试样制备
5.1.1 固体试样
取一定量混匀试样(软胶囊除外),精密称定(试样中总三萜的量约为0.5~5mg),置50mL量瓶中,加氯仿(3.1.2)约30mL,超声处理30min,放冷,加氯仿至刻度,摇匀。离心,取上清液备用。
5.1.2 油类制品
准确称取混匀试样适量(试样中总三萜的量约为0.5~5mg),置于100mL容量瓶中,用乙酸乙酯(3.1.1)溶解并稀释至刻度,摇匀。
5.1.3 软胶囊制品
取一定量混匀的净胶囊内容物,精密称定(试样中总三萜的量约为0.5~5mg),置于100mL容量瓶中,加乙酸乙酯(3.1.1)约60mL,超声处理30min,放冷,加乙酸乙酯至刻度,摇匀。
5.2 标准曲线的制作
分别精密吸取熊果酸标准品溶液(3.3)0.00、0.10、0.20、0.40、0.80、1.00mL于蒸发皿中,于60℃水浴上蒸干,冷却后精密加入0.4mL5%香草醛冰乙酸溶液(3.4),转动蒸发皿使残渣溶解,再精密加1.0mL高氯酸(3.1.4),混匀后移入10mL具塞比色管中,置60℃水浴加热15min,取出,冰浴冷却后,精密加入冰乙酸5.0mL摇匀,15min后以1cm比色池于548nm波长测定吸光度,以吸光度为纵坐标,浓度为横坐标绘制标准曲线。
5.3 试样溶液的测定
精密量取试样上清液(5.1)1.0mL置蒸发皿中,于60℃水浴上蒸干。照标准曲线的制作(5.2)项下,自“冷却后精密加入0.4mL5%香草醛冰乙酸溶液……”起,同法操作,测定吸光度,根据标准曲线得到待测液中总三萜的浓度。
6 结果计算
试样中总三萜含量按下式计算:
Xi—试样中总三萜含量(以熊果酸计),单位为克每百克(g/100g);
Ci—由标准曲线查得测定样液中总三萜质量,单位为微克(μg);
m—试样的称样质量,单位为克(g);
V1—试样定容总体积,单位为毫升(mL);
V2—测定用试样体积,单位为毫升(mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
二十一、保健食品中虫草素的测定
1 范围
本方法规定了保健食品中虫草素的液相色谱测定方法。
本方法适用于保健品食品中虫草素的测定。
2 原理
试样经酸水溶解,加偏磷酸溶液沉淀干扰物质,反相色谱分离,与标准品的保留时间比较定性,以峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。
3.1 试剂
3.1.1 偏磷酸(HPO3)。
3.1.2 甲醇(CH3OH):色谱纯。
3.2 标准品
虫草素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 虫草素标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.3 标准溶液配制
3.3.1 虫草素标准储备溶液:精确称取虫草素标准样品(3.2)25.0mg于50mL容量瓶中,用水溶解并定容至刻度,摇匀,此溶液浓度为0.5mg/mL。贮存于-18°C 冰箱中,有效期3个月。
3.3.2 虫草素标准系列工作液:分别准确吸取不同体积的标准储备液(3.3.1),用水将其稀释成虫草素含量分别为 1mg/mL、2mg/mL、5mg/mL、10mg/mL、20mg/mL、50mg/mL 的标准工作液。临用时配制。
3.4 偏磷酸溶液(30.0g/L):称取30.0g偏磷酸(3.1.1),置于装有约600mL水的三角瓶中,在磁力搅拌器上搅拌溶解,转移至1000mL容量瓶中,用水定容至刻度,摇匀,待用。
3.5 微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 分析天平:感量分别为0.0001g和0.001g。
4.3 超声波清洗器。
4.4 离心机:转速≥4000r/min。
4.5 磁力搅拌器。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:取20粒以上片剂或胶囊试样进行粉碎、混匀,或取半固态试样混匀(软胶囊称取内容物),准确称取均匀试样1g(可根据样品中含量而定,精确至0.001g),置50mL容量瓶中,加水30mL,混匀,超声震荡30min,加入30.0g/L偏磷酸溶液(3.4)1.0mL,轻轻振荡,加水稀释至刻度,摇匀。样品经0.45μm 滤膜过滤后进液相色谱分析。
5.1.2 液体样品:准确吸取摇匀后的试样10 mL(可根据试样含量而定)于50mL容量瓶中,加水20mL,混匀,超声震荡30min,加入30.0g/L偏磷酸溶液(3.4)1.0mL,轻轻振荡,加水稀释至刻度,摇匀。样品经0.45μm 滤膜过滤后进液相色谱分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250 mm×4.6mm,5μm或性能相当者。
5.2.2 流动相:甲醇(3.1.2)+水,(15+85,v/v)。
5.2.3 流速:1.0 mL/min。
5.2.4 柱温:30℃。
5.2.5 检测波长:260nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的虫草素标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液虫草素的色谱峰面积,根据标准曲线得到待测液中虫草素的浓度,平行测定次数不少于两次。
虫草素的标准品和试样液相色谱图参见附录A的图A.1和图A.2。
6 结果计算
试样中虫草素含量按下式计算: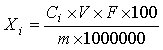
Xi——试样中虫草素的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Ci——由标准曲线查得测定样液中虫草素的浓度,单位为微克每毫升(mg/mL);
V——被测定样液的最终定容体积,单位为毫升(mL);
m——测定用试样的量,单位为克或毫升(g或mL);
100——单位转换;
1000000——单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录 A
标准溶液和试样溶液典型液相色谱图

二十二、保健食品中D-甘露醇的测定
1 范围
本方法规定了保健食品中D-甘露醇的高效液相色谱法测定方法。
本方法适用于保健食品中D-甘露醇含量的测定。
2 原理
试样中的D-甘露醇经提取后在氨基色谱柱上分离,用蒸发光散射检测器检测,根据保留时间定性,标准曲线法定量检测。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682 规定的一级水。
3.1 试剂
3.1.1 乙腈(CH3CN):色谱纯。
3.1.2 无水乙醇(C2H5OH)。
3.2 试剂配制
提取液:取40mL水与60mL无水乙醇(3.1.2)混合,即得。
3.3 标准品
D-甘露醇标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99%,或经国家认证并授予标准物质证书的标准物质。
表1 D-甘露醇标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.4 标准溶液的配制
3.4.1 D-甘露醇标准储备溶液:称取D-甘露醇标准样品(3.3)0.25g(精确至0.0001g),用水溶解,并转移至25mL容量瓶中,定容至刻度,此溶液浓度为10.0mg/mL。贮存于4℃冰箱中,有效期3个月。
3.4.2 标准系列溶液制备:分别准确吸取不同体积的标准储备液(3.4.1),用水将其稀释成D-甘露醇含量分别为0.1mg/mL、0.2mg/mL、0.5mg/mL、1.0mg/mL、2.0mg/mL、4.0mg/mL的标准系列工作液。临用时配制。
4 仪器和设备
4.1 高效液相色谱仪:配有蒸发光散射检测器(ELSD)。
4.2 超声波清洗器。
4.3 离心机:转速≥4000r/min。
4.4 分析天平:感量分别为0.0001g和0.01g。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:取20粒以上片剂或胶囊内容物进行粉碎、混匀,或取半固态试样混匀(软胶囊称取其内容物),准确称取均匀试样0.5g(可根据样品中含量而定,精确至0.001g),置圆底烧瓶中,加入25mL提取液(3.2),混匀,称重,水浴回流60min,取出,冷却后称重,补足减失的重量,摇匀,经0.45μm微孔滤膜过滤,滤液待分析。
5.1.2 液体样品:准确吸取一定量摇匀后的试样10mL(可根据试样含量而定,如少于10mL用水补足10mL)于25mL容量瓶中,加入无水乙醇(3.1.2)10mL,混匀,超声振荡30min,取出,冷却,用无水乙醇定容至刻度。混匀后经0.45μm滤膜过滤,供液相色谱分析用。
5.2 仪器参考条件
5.2.1 色谱柱:氨基液相色谱柱,250 mm×4.6mm,5μm,或同等性能色谱柱。
5.2.2 流动相:乙腈(3.1.1)+水,(25+75,v/v)。
5.2.3 柱温:30℃。
5.2.4 流速:1.0mL/min。
5.2.5 进样量:10mL。
5.2.6 蒸发光散射检测器:气体流速:1.60L/min,漂移管温度:60℃,增益:1。
5.3 标准曲线的制作
将标准系列工作液(3.4.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的标准溶液的色谱峰面积,以D-甘露醇的浓度(C)的对数LogC为横坐标,相应的色谱峰面积(A)的对数LogA为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液D-甘露醇的色谱峰面积,根据标准曲线得到待测液中D-甘露醇的浓度,平行测定次数不少于两次。
D-甘露醇的标准品和样品液相色谱图参见附录A的图A.1和图A.2。
6 结果计算
试样中D-甘露醇含量按下式计算:
X =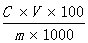
X——试样中D-甘露醇的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
C——由标准曲线查得测定样液中D-甘露醇的浓度,单位为毫克每毫升( mg/mL);
V——被测定样液的定容体积,单位为毫升( mL);
m——试样的称样质量,单位为克或毫升( g或mL);
100——单位转换;
1000——单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录 A
标准溶液和试样溶液典型液相色谱图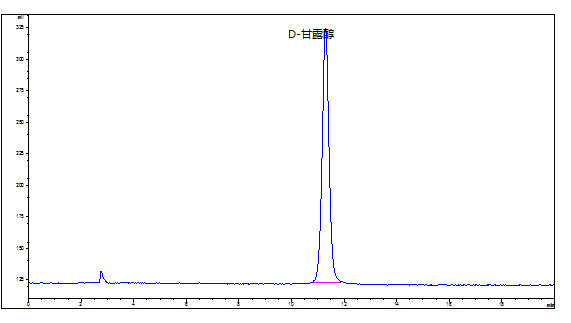

二十三、保健食品中功效成分/标志性成分食品安全国家标准检测方法
备注:推荐方法标准号根据相关食品安全国家标准同步更新。
第三部分
溶剂残留的测定
溶剂残留的测定
1 范围
本方法规定了保健食品中正丁醇、异丁醇、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯9种溶剂残留的气相色谱测定方法。
本方法适用于保健食品中正丁醇、异丁醇、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯9种溶剂残留的测定。
2 原理
样品经50% N,N-二甲基甲酰胺溶液提取后,采用顶空-气相色谱法测定,用外标法定量。
3 试剂和材料
注:水为GB/T 6682规定的二级水。
3.1 试剂
N,N-二甲基甲酰胺(HCON(CH3)2):色谱纯。
3.2试剂配制
N,N-二甲基甲酰胺溶液(50%):500mL N,N-二甲基甲酰胺与500mL水充分互溶混合。
3.3 标准品
正丁醇、异丁醇、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥97%,或经国家认证并授予标准物质证书的标准物质。
表1标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
3.4 标准溶液配制
3.4.1 标准储备液:分别称取正丁醇、异丁醇标准样品(3.3)1.2g(精确至0.0001g);正己烷、二乙烯苯标准样品(3.3)0.12g(精确至0.0001g);甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯标准样品(3.3)0.1g(精确至0.000 1 g),分别用N,N-二甲基甲酰胺(3.1)溶解,并分别转移至100mL容量瓶中,定容至刻度,得到正丁醇溶液、异丁醇溶液浓度为12mg/mL,正己烷溶液和二乙烯苯溶液浓度为1.2mg/mL,甲苯溶液、对二甲苯溶液、邻二甲苯溶液、苯乙烯溶液、1,2-二乙基苯溶液浓度为1mg/mL。贮存于4℃冰箱中。
3.4.2 混合标准中间液:分别准确吸取上述标准储备液(3.4.1)各1.0mL于同一100mL容量瓶中,用50% N,N-二甲基甲酰胺溶液(3.2)定容至刻度,摇匀。该混合标准中间液中正丁醇、异丁醇浓度为120μg/mL,正己烷、二乙烯苯浓度为12.0μg/mL,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为10.0μg/mL。贮存于4℃冰箱中。
3.4.3 标准系列工作液:分别准确吸取不同体积的混合标准中间液,用50% N,N-二甲基甲酰胺溶液将其稀释成正丁醇、异丁醇浓度分别为0.60μg/mL、2.4μg/mL、6.0μg/mL、12μg/mL、24μg/mL、60μg/mL,正己烷、二乙烯苯浓度分别为0.060μg/mL、0.24μg/mL、0.60μg/mL、1.2μg/mL、2.4μg/mL、6.0μg/mL;甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度分别为0.050μg/mL、0.20μg/mL、0.50μg/mL、1.0μg/mL、2.0μg/mL、5.0μg/mL标准系列工作液。临用时配制。
4 仪器和设备
4.1 气相色谱仪:配有氢火焰离子化检测器(FID)。
4.2 顶空自动进样器。
4.3 顶空瓶:20mL,配备铝盖和不含烃类溶剂残留的丁基橡胶或硅树脂胶隔垫。
4.4 分析天平:感量分别为0.0001g和0.001g。
4.5 超声波清洗器。
5 分析步骤
5.1 试样制备
5.1.1 固体基质
准确称取0.5g试样(精确至0.001g)于20mL顶空瓶中,加入5mL 50% N,N-二甲基甲酰胺溶液混匀后密封,超声处理10min,即得。
5.1.2 液体基质
准确称取1.0g至2.0g试样(精确到0.001g)于10mL容量瓶中,加入50% N,N-二甲基甲酰胺溶液定容至刻度,混匀,准确吸取5mL溶液至20mL顶空瓶中,密封,即得。
5.1.3油类基质
称取0.5g试样(精确到0.001g)于10mL容量瓶中,加入N,N-二甲基甲酰胺(3.1)定容至刻度,混匀,准确吸取5mL溶液至20mL顶空瓶中,密封,即得。
5.2 仪器参考条件
5.2.1 顶空进样参考条件
a)平衡时间:30min。
b)平衡温度:90℃。
c)进样体积:1.0mL。
5.2.2 色谱参考条件
a)色谱柱:以键合/交联聚乙二醇为固定相的毛细管柱,柱长为30m,内径为0.32mm,膜厚度为0.50μm,或性能相当者。
b)柱温箱温度:起始温度40℃,保持5min,10℃/min 升温至150℃,保持1min,再以20℃/min升至200℃,保持2min。
c)进样口温度:200℃。
d)分流比:15∶1。
e)FID 检测器温度:250℃。
f)载气:高纯氮气,流量 1.5mL/min,尾吹30mL/min。
g)氢气流量:40mL/min。
h)空气流量:300mL/min。
5.3 标准曲线的制作
准确吸取各浓度标准系列工作液(3.4.3)5mL置于顶空瓶中,分别按仪器参考条件(5.2)进行测定,得到相应的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按仪器参考条件(5.2)进行测定,得到相应的样品溶液溶剂残留的色谱峰面积,根据标准曲线得到待测液中各溶剂残留的浓度,平行测定次数不少于两次。
各溶剂残留的标准气相色谱图参见附录A的图A.1。
6 结果计算
试样中各溶剂残留含量按下式计算:
X—试样中各溶剂残留的含量,单位为毫克每千克(mg/kg);
C—由标准曲线得出的样液中各溶剂残留的浓度,单位为微克每毫升(μg/mL);
V—供试样溶液的体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%。
8 其它
当称样量为0.5g时,正丁醇、异丁醇检出限为2mg/kg,定量限为6mg/kg,正己烷、二乙烯苯的检出限为0.2mg/kg,定量限为0.6mg/kg,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯检出限为0.08mg/kg,定量限为0.30mg/kg。
附录A
溶剂残留的气相色谱图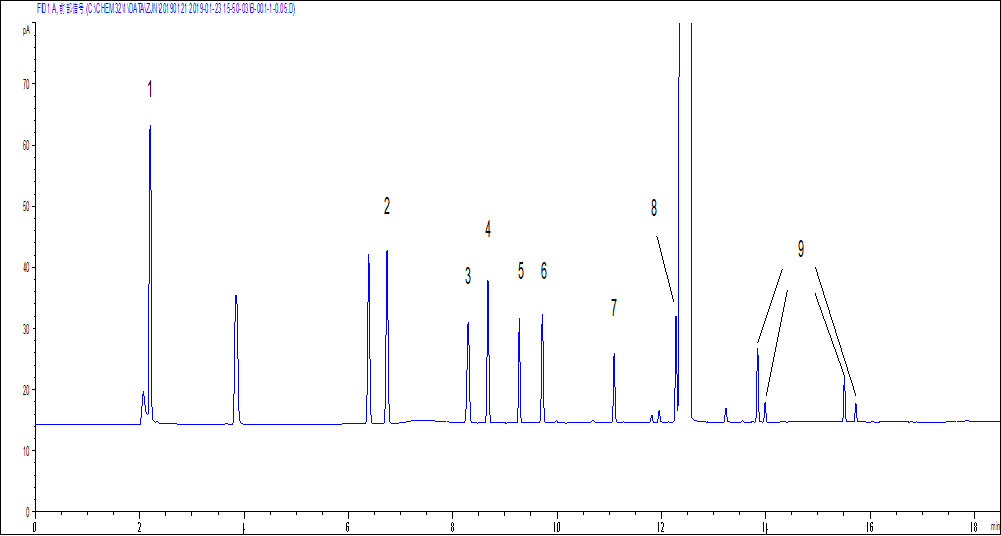
7:苯乙烯;8:1,2-二乙基苯;9:二乙烯苯
第四部分
违禁成分的测定
违禁成分测定
备注:违禁成分和检测方法根据监管部门的规定陆续更新。
第一部分 总则 3
一、主题内容和适用范围 4
二、基本要求 5
第二部分 功效成分/标志性成分检验方法 7
一、保健食品中红景天苷和酪醇的测定 8
二、保健食品中大蒜素的测定
三、保健食品中芦荟苷的测定
四、保健食品中左旋肉碱的测定
五、保健食品中α-亚麻酸、γ-亚麻酸的测定
六、保健食品中人参皂苷的测定
七、保健食品中前花青素的测定 31
八、保健食品中核苷酸的测定
九、保健食品中洛伐他汀的测定
十、保健食品中槲皮素、山柰素、异鼠李素的测定
十一、保健食品中茶氨酸的测定
十二、保健食品中五味子醇甲、五味子甲素和乙素的测定
十三、保健食品中腺苷的测定
十四、保健食品中总皂苷的测定
十五、保健食品中总黄酮的测定
十六、保健食品中壳聚糖脱乙酰度的测定
十七、保健食品中总蒽醌的测定
十八、保健食品中10-羟基-2-癸烯酸的测定
十九、保健食品中绞股蓝皂苷XL IX的测定
二十、保健食品中总三萜的测定
二十一、保健食品中虫草素的测定
二十二、保健食品中D-甘露醇的测定
二十三、保健食品中功效成分/标志性成分食品安全国家标准检测方法 89
第三部分 溶剂残留的测定 90
第四部分 违禁成分的测定 95
第一部分 总则
一、主题内容和适用范围
1.本指导原则规定了保健食品及其原料、辅料理化及卫生指标检验与评价的基本要求、功效成分/标志性成分检验方法、溶剂残留和违禁成分的测定要求。
2.本指导原则适用于保健食品的注册和备案检验。
二、基本要求
1. 保健食品应符合《食品安全国家标准 保健食品》(GB 16740)的各项要求和检验方法规定。对于不同配方、不同形态、不同工艺的产品,申请人应同时制定符合要求的理化、功效成分/标志性成分、微生物等指标对产品质量进行有效控制。
2. 直接接触保健食品的包装材料应符合相应食品安全国家标准及相关规定。
3. 普通食品形态产品应检测并制定净含量及允许负偏差指标,指标应符合《定量包装商品净含量计量检验规则》(JJF 1070)规定。胶囊等非普通食品形态产品应制定装量或重量差异指标。装量或净含量只检测内容物,不包括隔离材料。
4. 最小服用单元含有惰性隔离材料填充的产品,如胶囊,其功效成分或者指标成分、农药残留、灰分、水分等指标以去除隔离材料(胶囊壳)的内容物为检测单元,对于非法添加药物、重金属、铬、色素(如材料带颜色)等则需要进行整体检测,或者检测结果明确标识相关检测部位。
5. 本指导原则第二部分提供的检测方法为推荐方法,注册申请人在对产品进行功效成分/标志性成分检测时,应选择适合相应产品的检测方法。申请注册检验时,应提供该产品的配方、工艺、产品技术要求及功效成分/标志性成分检测方法以及检测方法的适用性、重现性等方法学研究材料。检测方法应科学、适用、重现。注册检验机构对所附材料进行审核,必要时进行有关验证和方法确认,如申报单位提供的方法不适合送检的样品时,注册检验机构不得擅自修改,应将有关情况反馈申报单位,由其进行研究并提供方法后,再对送检样品进行试验,确保试验方法与送检产品技术要求中规定的方法一致。复核检验机构应按照申报单位提交的检验方法进行检验并出具复核检验报告。
6. 注册申请人应当自行开展或委托具备法定资质的注册检验机构,按照国家相关规定和标准等要求,根据样品具体情况,合理地进行稳定性试验设计和研究。通过稳定性试验,考察样品在不同环境条件下(如温度、相对湿度等)的化学、物理及生物学特征随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。产品稳定性重点考察指标,主要包括感官、微生物、崩解时限(溶散时限、溶化性等)、水分、pH值、酸价、过氧化值、列入理化指标中的特征成分等随储存条件和储存时间容易发生变化的指标。产品非稳定性重点考察指标,主要包括鉴别、灰分、污染物(如铅、总砷、总汞等)、真菌毒素、农残(如六六六、滴滴涕等)、国家相关标准及现行规定有用量限制的合成色素和甜味剂等随储存条件和储存时间不易发生变化的指标,以及国家相关标准及现行规定有用量限制的抗氧化剂指标。
稳定性试验为注册申请人自行开展的,组织实施的检验质量控制、报告编制、样品和档案管理等工作以及出具的报告格式内容,应当符合有关规定。稳定性试验为注册申请人委托检验的,被委托单位应当为具有法定资质的食品检验机构。
7. 标准规定不得检出的项目结果,检测结果在方法定量限以上时,按照具体检出值报送结果;检测结果在方法检出限以下时,注明“未检出,检出限值”;检测结果在方法检出限以上、定量限以下时,注明“检出且小于定量限,定量限值,检出限值”。
8. 保健食品中原料和辅料应符合保健食品原辅料质量要求的有关规定,有适用的国家相关标准、地方标准、行业标准等的,其质量应符合相关规定。原辅料质量要求内容有缺项难以或无需制定的,应说明原因。原料若为植物提取物或者原料及辅料加工过程中使用、间接引入有机溶剂时,涉及的有机溶剂应符合《食品安全国家标准 食品添加剂使用标准》(GB 2760)附录C中食品工业用加工助剂使用名单规定,或有关规定。企业可根据产品质量控制需要,采用本指导原则中第三部分溶剂残留的测定方法将溶剂残留检测列入原料或产品的技术要求。
9. 违禁成分的检测作为相应保健功能类别产品的功能试验样品注册检验要求,应当符合本指导原则第四部分的规定。
第二部分
功效成分/标志性成分检验方法
一、保健食品中红景天苷和酪醇的测定
1 范围
本方法规定了以红景天为主要原料的保健食品中红景天苷和酪醇的液相色谱测定方法。
本方法适用于保健食品中红景天苷和酪醇的测定。
2 原理
试样经甲醇超声提取,以0.01mol/L乙酸铵-甲醇为流动相(80+20),采用高效液相色谱法,紫外检测器检测,根据保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 乙酸铵(CH3COONH4)。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 甲醇(CH3OH)。
3.2 标准品
红景天苷、酪醇标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 红景天苷、酪醇标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 红景天苷 | Salidroside | 10338-51-9 | C14H20O7 | 300.30 |
| 酪醇 | Tyrosol | 501-94-0 | C8H10O2 | 138.16 |
3.3.1 红景天苷标准储备液(2.0mg/mL):准确称取红景天苷标准品20mg(精确至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,摇匀。
3.3.2 红景天苷标准工作液:将红景天苷标准储备液(3.3.1)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.20mg/mL、0.50mg/mL,临用时配制。
3.3.3 酪醇标准储备液(2.0mg/mL):准确称取酪醇标准品20mg(精确至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,摇匀。
3.3.4 酪醇标准工作液:将酪醇标准储备液(3.3.3)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.10mg/mL、0.20mg/mL,临用时配制。
3.3.5 系统适用性溶液:量取红景天苷标准储备液(3.3.1)和酪醇标准储备液(3.3.3)各0.5mL于10mL容量瓶中,用甲醇(3.1.2)稀释至刻度,摇匀。
3.4 试剂配制
乙酸铵溶液(0.01mol/L):称取0.77g乙酸铵,加入适量水溶解并定容至1000mL,经0.45μm滤膜(3.5.1)过滤后备用。
3.5 材料
3.5.1 水相微孔滤膜:0.45µm。
3.5.2 有机相微孔滤膜:0.45µm。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外检测器(UV)。
4.2 超声波清洗器。
4.3 分析天平:感量为0.01mg和0.0001g。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:准确称取已粉碎混合均匀的固体待测试样适量(约含红景天苷5mg)于 25mL容量瓶中,加入甲醇(3.1.3)约20mL,超声提取30min,放冷至室温,用甲醇(3.1.3)定容至刻度。混匀后经0.45μm滤膜(3.5.2)过滤,供液相色谱分析用。
5.1.2 液体样品:准确吸取摇匀后的待测试样适量(约含红景天苷5mg),置于蒸发皿内,水浴蒸干,用甲醇溶解并(3.1.3)转移至25mL容量瓶中并定容至刻度。混匀后经0.45μm滤膜(3.5.2)过滤,供液相色谱分析用。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm, 5μm,或同等性能色谱柱;
5.2.2 流动相:乙酸铵溶液(0.01mol/L)-甲醇(80+20);
5.2.3 流速:1.0mL/min;
5.2.4 柱温:25℃;
5.2.5 检测波长:215nm;
5.2.6 进样量:10mL。
5.2.7 系统适用性试验:取系统适用性溶液(3.3.5)10mL,注入液相色谱仪,记录色谱图,红景天苷峰与酪醇峰的分离度应大于1.5。
5.3 标准曲线的制作
将红景天苷标准系列工作液(3.3.2)或酪醇标准系列工作液(3.3.4)分别注入高效液相色谱仪中,测定相应的色谱峰高或峰面积,以标准工作液的浓度为横坐标,以峰面积或峰高为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1)。
5.4 试样溶液的测定
将试样待测液(5.1.1或5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积或峰高,根据标准曲线得到待测液红景天苷或酪醇的浓度(样品溶液液相色谱图见附录A中图A.2)。
6 结果计算
试样中红景天苷或酪醇含量按下式计算:
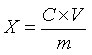
X—试样中红景天苷或酪醇的含量,单位为毫克每克或毫克每毫升(mg/g或mg/mL);
C—由标准曲线查得待测样液中红景天苷或酪醇的浓度,单位为毫克每毫升(mg/mL);
V—样品的定容体积,单位为毫升(mL);
m—样品量,单位为克或毫升(g或mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录 A
标准溶液和试样溶液典型液相色谱图


二、保健食品中大蒜素的测定
1 范围
本方法规定了保健食品中大蒜素(二烯丙基三硫化物)的测定方法。
本方法适用于以大蒜及其加工品为主要原料制成的保健食品中大蒜素(二烯丙基三硫化物)的测定。
2 原理
试样经有机溶剂提取,通过气相色谱检测,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯。
3.1 试剂
3.1.1 无水乙醇(C2H5OH)。
3.1.2 正己烷(CH3(CH2)4CH3)。
3.1.3 无水硫酸钠(Na2SO4)。
3.2 标准品
大蒜素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99.0%,或经国家认证并授予标准物质证书的标准物质。
表1 大蒜素标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 大蒜素 | Allitride | 2050-87-5 | C6H10S3 | 178.33 |
3.3.1 大蒜素标准储备液(5.0mg/mL):称取125.0mg大蒜素于25mL容量瓶中,用正己烷(3.1.2)定容至刻度,摇匀。此溶液可在4℃冰箱中保存七天。
3.3.2 大蒜素标准工作液:分别准确吸取不同体积的标准储备液(3.3.1),用正己烷(3.1.2)将其稀释成大蒜素含量分别为0.1mg/mL、0.5mg/mL、1.0mg/mL、1.5mg/mL、2.0mg/mL的标准系列工作溶液,临用配制。
3.4 材料
微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 气相色谱仪:配有氢火焰离子化检测器(FID)。
4.2 分析天平:感量为0.01mg和0.0001g。
4.3 超声清洗器。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的固体待测试样适量(含待测组分约5mg,精确到0.0001g)于5mL容量瓶中,加无水乙醇2.5mL,密塞,超声(功率800W,频率40kHz)提取20min,取出冷却至室温,加正己烷定容,摇匀,过0.45μm微孔滤膜过滤,待上机测试用。
5.1.2 油状试样
称取已混合均匀的油状待测试样适量(含待测组分约5mg,精确到0.0001g)于5mL容量瓶中,加正己烷溶解并定容,摇匀,过0.45μm微孔滤膜过滤,待上机测试用。
5.1.3 含水液体试样
精密吸取已混合均匀的待测试样适量(含待测组分约10mg),置于分液漏斗中,加4mL正己烷振摇提取1min,静置分层,取上层清液过无水硫酸钠,提取两次。用适量正己烷冲洗无水硫酸钠,合并至同一10mL容量瓶中,用正己烷定容至刻度,摇匀。过0.45μm微孔滤膜过滤,待上机测试用。
5.2 仪器参考条件
5.2.1 色谱柱:(5%-苯基)-甲基聚硅氧烷固定相,柱长30m,内径0.25mm,膜厚0.25μm或其他同等性能色谱柱。
5.2.2 柱温箱温度:起始温度100℃保持3min,10℃/min速度升至150℃,再以20℃/min速度升至200℃,保持20min。
5.2.3 进样口温度:220℃。
5.2.4 检测器温度:250℃。
5.2.5 载气:高纯氮气,流量1.0mL/min。
5.2.6 氢气:40mL/min;空气:400mL/min。
5.2.7 进样量:1μL。
5.3 测定
将1μL的标准工作溶液(3.3.2)和试样溶液(5.1)注入气相色谱仪中,以保留时间定性,测得峰面积或峰高,外标法定量。
标准工作溶液图谱及试样溶液图谱见附录A。
6 结果计算
试样中大蒜素含量按下式计算:

W—大蒜素的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
A1—试样溶液色谱峰面积或峰高;
A2—标准工作液峰面积或峰高;
C—标准工作液浓度,单位为毫克每毫升(mg/mL);
V—试样定容体积,单位为毫升(mL);
m—试样的质量或体积,单位为克或毫升(g或mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型气相色谱图


三、保健食品中芦荟苷的测定
1 范围
本方法规定了保健食品中芦荟苷含量的高效液相色谱测定方法。
本方法适用于以芦荟及其加工品为主要原料的保健食品中芦荟苷含量的测定。
2 原理
样品用甲醇+水(55+45)作为溶剂,提取试样中的芦荟苷,经C18柱分离,在293nm波长处检测,以芦荟苷保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 石油醚:沸程30℃~60℃。
3.2 标准品
芦荟苷标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥90%,或经国家认证并授予标准物质证书的标准物质。
表1 芦荟苷标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 芦荟苷 | Aloin | 1415-73-2 | C21H22O9 | 418.39 |
3.3.1 芦荟苷标准储备液:称取芦荟苷标准样品(3.2)10mg(精确至0.01mg)于25mL容量瓶中,加流动相溶解并定容至刻度,摇匀,此溶液浓度为0.4mg/mL。临用新配。
3.3.2 芦荟苷标准系列工作液:分别准确吸取芦荟苷标准储备液(3.3.1)0.5mL、1.0mL、2.0mL、4.0mL、6.0mL至10mL容量瓶中,用流动相定容,得浓度为0.02mg/mL、0.04mg/mL、0.08mg/mL、0.16mg/mL、0.24mg/mL的标准系列工作液。
3.4 微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 超声波清洗器。
4.3 分析天平:感量分别为0.01mg和0.001g。
4.4 离心机:转速≥3000r/min。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的待测试样适量(约含芦荟苷4mg,精确到0.001g),置具塞锥形瓶中,加入50.0mL流动相(5.2.2),称重,超声处理20min,放冷,用流动相补足减失的重量,摇匀,经微孔滤膜(3.4)过滤,滤液待测。必要时可进行适当稀释。
5.1.2 含油基质试样
称取已粉碎混合均匀的待测试样适量(约含芦荟苷4mg,精确到0.001g),置具塞锥形瓶中,加入25.0mL石油醚(3.1.2),涡旋使充分混匀,过滤,弃去石油醚液,再用少量石油醚洗涤锥形瓶及滤纸,挥干,将滤纸和残渣置于原具塞锥形瓶中,加入50.0mL流动相(5.2.2),称重,超声处理20min,放冷,用流动相补足减失的重量,摇匀,经微孔滤膜(3.4)过滤,滤液待测。必要时可进行适当稀释。
5.1.3 水性液体试样
吸取待测试样,必要时以流动相(5.2.2)适当稀释,离心,取上清液经微孔滤膜(3.4)过滤。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm,5μm,或性能相当者。
5.2.2 流动相:甲醇(3.1.1)+水,(55+45,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:40℃。
5.2.5 检测波长:293nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的芦荟苷标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液芦荟苷的色谱峰面积,根据标准曲线得到待测液中芦荟苷的浓度,平行测定次数不少于两次。
芦荟苷的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中芦荟苷含量按下式计算:
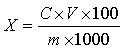
X—试样中芦荟苷的含量,单位为克每百克(g/100g)或克每百毫升(g/100mL);
C—由标准曲线得出的样液中芦荟苷的浓度,单位为毫克每毫升(mg/mL);
V—试样的最终定容体积,单位为毫升(mL);
m—试样取样量,单位为克(g)或毫升(mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
芦荟苷的高效液相色谱图

四、保健食品中左旋肉碱的测定
1 范围
本方法规定了保健食品中左旋肉碱的液相色谱测定方法。
本方法适用于以左旋肉碱为主要原料的保健食品中肉碱的含量测定。
2 原理
试样中的左旋肉碱以0.50mmol/L的盐酸溶液经超声提取,反相色谱分离,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 磷酸氢二钾(K2HPO4)。
3.1.2 辛烷磺酸钠(C8H17NaO3S)。
3.1.3 盐酸(HCl):含量:36%~38%。
3.1.4 磷酸(H3PO4)。
3.1.5 硅藻土(SiO2):粒径范围:0.2-0.8mm。
3.1.6 乙腈(CH3CN):色谱纯。
3.2 标准品
左旋肉碱标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 左旋肉碱标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 左旋肉碱 | L-Carnitine | 541-15-1 | C7H15NO3 | 161.20 |
3.3.1 左旋肉碱标准储备液:称取25mg(准确至0.01mg)左旋肉碱标准品(3.2)于25mL容量瓶中,用盐酸溶液(3.4)溶解并定容至刻度,摇匀。此溶液浓度为1.0mg/mL。
3.3.2 左旋肉碱标准系列工作液:分别准确吸取左旋肉碱标准储备液(3.3.1)0.50mL、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL于5mL容量瓶中,用盐酸溶液(3.4)稀释至刻度,得浓度分别为0.10mg/mL、0.20mg/mL、0.40mg/mL、0.60mg/mL、0.80mg/mL、1.00mg/mL的标准系列工作液。临用时配制。
3.4 盐酸溶液(0.5mmol/L):准确吸取4.2mL盐酸(3.1.3),用水定容至100mL。摇匀后,再吸取上述溶液1.0mL,用水定容至1L。
3.5 缓冲盐溶液:分别准确称取3.4g磷酸氢二钾(3.1.1)和0.4325g辛烷磺酸钠(3.1.2),用水溶解并定容至1L,摇匀,用磷酸(3.1.4)调至pH=2.5,经微孔滤膜(3.6)过滤,待用。
3.6 微孔滤膜:0.45μm,水相。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
4.2 分析天平:感量分别为0.01mg、0.0001g和0.001g。
4.3 超声波提取器:功率250W,频率33kHz。
5 分析步骤
5.1 试样制备
5.1.1 试样提取
5.1.1.1 固体试样
准确称取粉碎并混合均匀的试样0.1g~2g(准确至0.0001g,含待测组分约5mg~50mg),于50mL容量瓶中,加入盐酸溶液(3.4)约35mL,超声提取10min,放至室温,用盐酸溶液(3.4)稀释至刻度,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.1.2 软胶囊试样
取软胶囊剪开,挤出内容物并混匀,准确称取2g(准确至0.0001g),准确加入等量硅藻土(3.1.5),研至分散均匀,准确称取其中部分(准确至0.0001g,含待测组分约5mg~50mg),转移至250mL具塞三角瓶中,吸取盐酸溶液(3.4)50.0mL,并入三角瓶中,称重(准确至0.001g),加塞超声提取10min,放至室温,用盐酸溶液(3.4)补足重量,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.1.3 液体试样
准确吸取混匀后的试样1.0mL~5.0mL(含待测组分约5mg~50mg),于50mL容量瓶中,加入盐酸溶液(3.4)约35mL,超声提取10min,放至室温,用盐酸溶液(3.4)稀释至刻度,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.2 试样溶液稀释
必要时,根据试样溶液中左旋肉碱含量,用盐酸溶液(3.4)进行适当的稀释(稀释倍数F),使待测溶液中左旋肉碱的浓度在0.10mg/mL~1.00mg/mL范围内。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱: 250mm×4.6mm,5μm或同等性能的色谱柱。
5.2.2 流动相:缓冲盐溶液(3.5)+乙腈(3.1.6),(90+10,v/v)。
5.2.3 流速:0.8mL/min。
5.2.4 检测波长:210nm。
5.2.5 进样量:20μL。
5.3 标准曲线的制作
将左旋肉碱标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的左旋肉碱标准溶液的色谱峰面积。以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 待测溶液的测定
将待测溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的待测溶液左旋肉碱的色谱峰面积,根据标准曲线得到待测溶液中左旋肉碱的浓度,平行测定次数不少于两次。
左旋肉碱的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中左旋肉碱含量按下式计算:
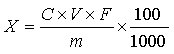
X—试样中左旋肉碱的含量,固体和软胶囊试样的单位为克每百克(g/100g),液体试样的单位为克每百毫升(g/100mL);
C—根据标准曲线计算待测溶液中左旋肉碱的浓度,单位为毫克每毫升(mg/mL);
V—试样提取时的定容体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);或液体试样吸取的体积,单位为毫升(mL);
F—稀释倍数;
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录 A
左旋肉碱的高效液相色谱图

五、保健食品中α-亚麻酸、γ-亚麻酸的测定
1 范围
本方法规定了保健食品中α-及γ-亚麻酸的测定方法。
本方法适用于油脂类保健食品中α-及γ-亚麻酸含量的测定。
2 原理
将油脂试样(或试样提取的脂肪),经氢氧化钾皂化,在三氟化硼存在下甲醇酯化,然后用气相色谱仪分析,采用外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 正己烷(C6H14)。
3.1.2 氢氧化钾(KOH)。
3.1.3 三氟化硼甲醇溶液:浓度为15%。
3.1.4 甲醇(CH3OH):色谱纯。
3.1.5 氯化钠(NaCl)。
3.2 标准品
α-、γ-亚麻酸甲酯标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99.0%,或经国家认证并授予标准物质证书的标准物质。
表1 α-、γ-亚麻酸甲酯标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| α-亚麻酸甲酯 | Methy α- linolenate | 301-00-8 | C19H32O2 | 292.46 |
| γ-亚麻酸甲酯 | Methy γ- linolenate | 16326-32-2 | C19H32O2 | 292.46 |
3.3.1标准储备液:称取α-亚麻酸甲酯、γ-亚麻酸甲酯标准品(3.2)各25.0mg(精确至0.01mg),分别置25mL容量瓶中,用正己烷(3.1.1)溶解并定容至刻度,溶液浓度为1.0mg/mL。贮存于-18℃冰箱中。
3.3.2 标准工作液:吸取α-亚麻酸甲酯和γ-亚麻酸甲酯标准储备液,稀释成含量分别为0.10mg/mL、0.20mg/mL、0.40mg/mL、0.50mg/mL的混合标准系列工作液。临用时配制。
3.4氢氧化钾甲醇溶液(0.5mol/L):称取氢氧化钾(3.1.2)2.8g,用甲醇(3.1.4)溶解并定容至100mL,混匀。
3.5 饱和氯化钠溶液:称取氯化钠(3.1.5)360g,溶解于1.0L水中,搅拌溶解,澄清备用。
4 仪器和设备
4.1 气相色谱仪:配有氢火焰(FID)检测器。
4.2 分析天平:感量分别为0.0001g和0.001g。
4.3 加热式磁力搅拌器。
4.4 标准磨口烧瓶(50mL)和直形冷凝管。
5 分析步骤
5.1 试样制备
5.1.1 脂肪的提取 按GB 5009.6中规定的方法提取。
5.1.2 皂化
称取0.100g油脂(或脂肪)和磁力搅拌子一并放入50mL磨口烧瓶中(见图1)加入4mL 0.5mol/L氢氧化钾甲醇溶液,上部连接回流冷凝管,并固定于磁力搅拌器上,由冷凝管上口向溶液中导入氮气,使反应瓶中始终充满氮气。开启磁力搅拌器,并加热使反应液保持65±5℃,搅拌回流约15min(至无油滴为止)。
5.1.3 甲酯化
从冷凝管上部加入4mL三氟化硼甲醇溶液,搅拌(65±5℃),回流约2min,冷至室温, 从冷凝管上部加入5mL正己烷继续搅拌5min,移去冷凝管,加入5mL饱和氯化钠水溶液, 摇动数分钟,转移至25mL分液漏斗中分离水与有机相,再加3mL正己烷洗水相,分离,弃水相,合并有机相并用正己烷定容至10.0mL(浓度低时吹氮浓缩至1.0mL),供测定用。
5.2 仪器参考条件
5.2.1 色谱柱:FFAP(改性聚乙二醇20M,30m×0.25mm i.d.0.25μm)
5.2.2 柱箱温度:215℃。
5.2.3 进样口温度:250℃。
5.2.4 检测器温度:260℃。
5.2.5 氮气:1.5mL/min,载气:50mL/min。
5.3定性分析
在上述仪器条件下,分别取标准储备液和试样测定液1.0μL,注入气相色谱仪,以保留时间来确定α-及γ-亚麻酸甲酯。
5.4 定量分析
试样中α-亚麻酸甲酯或γ-亚麻酸甲酯色谱峰面积或峰高与标准的比较定量。
标准样品溶液和试样溶液液相色谱图参见附录A的图A.1和图A.2。
6 结果计算
α-亚麻酸甲酯或γ-亚麻酸含量(以脂肪计)按下式计算:

X—α-亚麻酸或γ-亚麻酸含量(以脂肪计),g/100g;
A1—试样待测液中α-亚麻酸甲酯或γ-亚麻酸甲酯色谱峰面积或峰高;
A2—标准使用液色谱峰面积或峰高;
ρ—标准使用液浓度,mg/mL;
v—正己烷定容体积,mL;
m—试样质量,g;
0.952—亚麻酸换算系数。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。

附录A
标准溶液和试样溶液典型液相色谱图


六、保健食品中人参皂苷的测定
1 范围
本方法规定了保健食品中人参皂苷的高效液相色谱测定方法。
本方法适用于以人参及其加工品为主要原料的保健食品中人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd含量的测定。
2 原理
将试样中的人参皂苷溶解、提取,经净化处理后,使用梯度洗脱反相高效液相色谱进行分离,紫外检测器检测(或蒸发光散射检测器),根据色谱峰的保留时间定性,外标法定量。
3 试剂和材料
注:水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 乙腈(CH3CN):色谱纯。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 D101大孔吸附树脂(粒径:I.D φ15*L150mm)。
3.2 标准品
人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 人参皂苷标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 人参皂苷Re | Ginsenoside Re | 52286-59-6 | C48H82O18 | 947.15 |
| 人参皂苷Rg1 | Ginsenoside Rg1 | 22427-39-0 | C42H72O14 | 801.01 |
| 人参皂苷Rb1 | Ginsenoside Rb1 | 41753-43-9 | C54H92O23 | 1109.29 |
| 人参皂苷Rc | Ginsenoside Rc | 11021-14-0 | C53H90O22 | 1079.27 |
| 人参皂苷Rb2 | Ginsenoside Rb2 | 11021-13-9 | C53H90O22 | 1079.27 |
| 人参皂苷Rd | Ginsenoside Rd | 52705-93-8 | C48H82O18 | 947.15 |
3.3.1 人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准储备液:分别称取人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准样品(3.2)100mg于6个10mL容量瓶中,用甲醇溶解并定容至刻度,摇匀,溶液浓度为10mg/mL。
3.3.2 人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd混合标准系列工作液:分别精密吸取不同体积的标准储备液(3.3.1)于同一10mL容量瓶中,用甲醇将其稀释成人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd含量分别为0.10mg/mL、0.20mg/mL、0.40mg/mL、0.80mg/mL、1.00mg/mL的混合标准系列工作液。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外检测器或蒸发光散射检测器。
4.2 超声波清洗器。
4.3 离心机。
4.4 水浴锅。
4.5 分析天平:感量分别为0.1mg和0.001g。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
取试样研成粉末,并过20目筛。称取该粉末样适量(相当于含总人参皂苷约75mg,精确至0.001g),于50mL容量瓶中,加水45mL于超声波清洗器中超声提取30分钟,取出,待放至室温后,加水定容至刻度,摇匀,滤过,准确吸取续滤液10mL,通过D101大孔吸附树脂净化柱(3.1.3)(大孔吸附树脂使用前先经甲醇浸泡,水洗,装成10cm长,直径1~1.5cm的小柱),小柱先用10mL水冲洗,弃去水液之后,用70%甲醇25mL洗脱皂苷,收集甲醇溶液,水浴上蒸干,残渣以甲醇(3.1.2)溶解并定容至5.0mL,该样液离心后过0.45μm尼龙滤膜,滤液进液相色谱仪分析。
5.1.2 液体试样
取一定量的试样(相当于含总人参皂苷约75mg),旋转蒸发至干,残渣以50mL水超声提取30分钟,余下步骤与5.1.1相同。
5.1.3 软胶囊试样
称取混合均匀的待测试样内容物适量(相当于含总人参皂苷约75mg,精确至0.001g),余下步骤与5.1.1相同。
5.2 色谱参考条件
5.2.1色谱柱:C18柱,250mm×4.6mm,5μm,或同等性能的色谱柱。
5.2.2流动相:A相为乙腈(3.1.1),B相为水,梯度洗脱条件见表2。
表2梯度洗脱条件
| 时间(min) | A相/ % | B相/ % |
| 0 | 16 | 84 |
| 20 | 18 | 82 |
| 55 | 40 | 60 |
| 65 | 40 | 60 |
| 66 | 100 | 0 |
| 71 | 100 | 0 |
| 72 | 16 | 84 |
| 85 | 16 | 84 |
5.2.4 柱温:35°C。
5.2.5 进样量:5μL。
5.2.6 紫外检测器条件:检测波长:203nm。
5.2.7 蒸发光散射检测器条件:
蒸发温度:105°C;漂移管温度:60°C;气流速:1.6L/min。
5.3 标准曲线的制作
将混合标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的峰面积,以标准工作液的浓度(或浓度对数)为横坐标,以峰面积(或峰面积对数)为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,以保留时间定性,测得峰面积,根据标准曲线得到试样溶液中人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd的浓度。
标准溶液和试样溶液的高效液相色谱图参见附录A(紫外检测器)和附录B(蒸发光散射检测器)。
6 结果计算
试样中各人参皂苷的含量按下式计算:
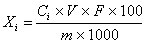
Xi——试样中各人参皂苷的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Ci——由标准曲线查得测定样液中各人参皂苷的浓度,单位为毫克每毫升(mg/mL);
V——被测定样液的最终定容体积,单位为毫升(mL);
F——被测定样液的稀释倍数;
m——试样的取样量,单位为克或毫升(g或mL);
100——单位转换;
1000——单位转换。
试样中总人参皂苷的含量按式(2)计算:
X总=XRe+XRg1+XRb1+XRc+XRb2+XRd………………(2)
式中:
X总—试样中总人参皂苷的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Xi—试样中各人参皂苷(Xi包括人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd)的含量,单位为克每百克或克每百毫升(g/100g或g/100mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图(紫外检测器)


附录B
标准溶液和试样溶液典型液相色谱图(蒸发光散射检测器)


七、保健食品中前花青素的测定
1 范围
本方法规定了保健食品中前花青素的测定方法。
本方法适用于保健食品中前花青素的含量测定。
2 原理
前花青素是含有儿茶素和表儿茶素单元的聚合物。前花青素本身无色,但经过热酸处理后,可以生成深红色的花青素离子。本法用分光光度法测定前花青素在水解过程中生成的花青素离子。计算试样中前花青素含量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH)。
3.1.2 正丁醇(CH3(CH2)3OH)。
3.1.3 盐酸(HCl)。
3.1.4 硫酸铁铵(NH4Fe(SO4)2·12H2O)
3.2 试剂配制
3.2.1 盐酸(2mol/L):取盐酸90mL,加水适量使成500mL,摇匀。
3.2.2 硫酸铁铵溶液:称取10g硫酸铁铵,用2mol/L盐酸溶解并定容至500mL,混匀,此溶液中硫酸铁铵浓度为2%(w/v)。
3.3 标准品
前花青素(葡萄籽来源)标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥95%,或经国家认证并授予标准物质证书的标准物质。
表1 前花青素(葡萄籽来源)标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 前花青素(葡萄籽来源) | Proanthocyanidins | 4852-22-6 | C30H26O13 | 594.52 |
3.4 标准品溶液的配制
前花青素标准储备液(1.0mg/mL):称取10mg(精确至0.1mg)前花青素标准品于10mL 容量瓶中,用甲醇溶解并定容至刻度,摇匀。
4 仪器和设备
4.1 分析天平:感量为0.1mg和0.001g。
4.2 分光光度计。
4.3 离心机:转速≥4000r/min。
4.4 超声仪。
4.5 回流装置。
5 分析步骤
5.1 试样制备
5.1.1 固体试样:称取已粉碎混合均匀的待测试样50mg~100mg(精确至0.1mg),置于50mL容量瓶中,加入30mL甲醇,超声处理20min,放冷至室温后,加甲醇至刻度,摇匀,离心或放置至澄清后取上清液备用。
5.1.2 含油试样:称取混合均匀的待测试样50mg(精确至0.1mg),置于小烧杯中,用20~30mL甲醇分数次搅拌,将提取液转移至50mL容量瓶中,直至甲醇提取液无色,加甲醇至刻度,摇匀。
5.1.3 液体试样:吸取不超过1mL的待测试样,置于50mL容量瓶中,加甲醇至刻度,摇匀。
5.2 试样测定
将正丁醇与盐酸按95:5的体积比混合后,取出6.0mL置于具塞锥形瓶中,再加入0.2mL硫酸铁铵溶液和1.0mL试样溶液,混匀,置沸水浴回流,精确加热40min后,立即置冰水中冷却,在加热完毕15min后,于546nm波长处测吸光度,由标准曲线计算试样中前花青素的含量。显色在1小时内稳定。
5.3 标准曲线制备
分别吸取前花青素标准储备液0.00mL、0.10mL、0.25mL、0.50mL、1.00mL、1.50mL置于10mL容量瓶中,加甲醇至刻度,摇匀。各吸取1.0mL测定,与试样测定方法相同。绘制前花青素浓度与吸光度关系的标准曲线。
6 结果计算
试样中前花青素测定结果按下式计算
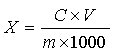
X—试样中前花青素的含量,g/100g;
C—由标准曲线上查出待测试样中前花青素的浓度,μg/mL;
V—待测试样定容总体积,mL;
m—试样质量,g。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
八、保健食品中核苷酸的测定
第一法
1 范围
本方法规定了保健食品中核苷酸的超高效液相色谱(UPLC)测定方法。
本方法适用于保健食品中核苷酸的测定。
2 原理
将试样溶解、去除蛋白后,经超高效液相色谱(UPLC)分离,以相对保留时间定性,峰面积定量。
3 试剂
注:除特殊说明,所用试剂均为分析纯,实验用水符合GB/T 6682一级水要求。
3.1 乙腈(CH3CN):优级纯。
3.2 乙酸(C2H4O2):36%~37%(g/g)。
3.3 磷酸(H3PO4)。
3.4 磷酸氢二钠(Na2HPO4)。
3.5 标准品
核苷酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥97%,或经国家认证并授予标准物质证书的标准物质。
表1:各核苷酸标准品的分子式、相对分子量、CAS登录号
| 名称 | 英文名 | CAS | 分子式 | 相对分子量 |
| 鸟嘌呤核苷酸 | Guanine nucleotide(GMP) | 85-32-5 | C10H14N5O8P | 363.22 |
| 腺嘌呤核苷酸 | Adenine nucleotide(AMP) | 61-19-8 | C10H14O7N5P | 347.22 |
| 次黄嘌呤核苷酸 | Hypoxanthine nucleotide(IMP) | 131-99-7 | C10H13N4O8P | 348.21 |
| 胞嘧啶核苷酸 | Cytosine nucleotide(CMP) | 63-37-6 | C9H14N3O8P | 323.20 |
| 尿嘧啶核苷酸 | Uracil nucleotide(UMP) | 58-97-9 | C9H13N2O9P | 324.18 |
3.6.1 核苷酸标准储备液:称取经100℃干燥4h处理的核苷酸标准品(3.5)各50mg(精确至0.1mg),用水溶解,并转移至100mL容量瓶中,定容至刻度,此溶液浓度为0.5mg/mL。
3.6.2 核苷酸标准系列工作液:分别准确吸取不同体积的标准储备液(3.6.1),用水将其稀释成核苷酸含量分别为10.0μg/mL、20.0μg/mL、40.0μg/mL、80.0μg/mL、100μg/mL的标准系列工作液。临用时配制。
4 仪器和设备
4.1 超高效液相色谱仪(UPLC):配有二极管阵列检测器或紫外检测器。
4.2 分析天平:感量分别为0.1mg和0.001g。
5 分析步骤
5.1 试样制备
5.1.1 不含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.22μm针孔滤膜,超液相色谱仪测定。
5.1.2 含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,加入乙酸(3.2)100μL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.22μm针孔滤膜,超高效液相色谱仪测定。
5.2 仪器参考条件
色谱柱:BEH Amide柱,2.1mm×100mm,1.7μm,或性能相当者。
流动相:A:乙腈、B:10mmol/L Na2HPO4水溶液、C:0.1%H3PO4水溶液,梯度洗脱。梯度表如下:
| 时间 | A% | B% | C% |
| 0.0 | 88.0 | 7.0 | 5.0 |
| 6.0 | 80.0 | 17.5 | 2.5 |
| 8.0 | 77.0 | 22.0 | 1.0 |
| 9.0 | 65.0 | 35.0 | 0.0 |
| 10.7 | 55.0 | 45.0 | 0.0 |
| 10.8 | 88.0 | 7.0 | 5.0 |
| 13.0 | 88.0 | 7.0 | 5.0 |
柱温:50℃。
检测波长:254nm。
进样量:1μL。
5.3 标准曲线的制作
将标准系列工作液(3.6.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的核苷酸标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定。
6 结果计算
试样中核苷酸测定结果按下式计算:
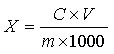
X-试样中核苷酸的含量,mg/g;
C-由标准曲线得出的试样溶液中核苷酸的浓度,μg/mL;
V-试样定容体积,mL;
m-试样称取的质量,g;
试样中总核苷酸的含量为胞嘧啶核苷(CMP)、尿嘧啶核苷(UMP)、腺嘌呤核苷(AMP)、鸟嘌呤核苷(GMP)、次黄嘌呤核苷(IMP)含量之和。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次测定结果的绝对差值不得超过算术平均值的10%。
第二法
1 范围
本方法规定了保健食品中核苷酸的高效液相色谱(HPLC)测定方法。
本方法适用于保健食品中核苷酸的测定。
2 原理
将试样溶解、去除蛋白后,经高效液相色谱分离,以相对保留时间定性,峰面积定量。
3 试剂
注:除特殊说明,所用试剂均为分析纯,实验用水符合GB/T 6682-2008一级水要求。
3.1 乙腈(CH3CN):优级纯。
3.2 乙酸(C2H4O2):36%~37%(g/g)。
3.3 磷酸(H3PO4)。
3.4 标准品
同方法一。
3.5 标准溶液配制
3.5.1 核苷酸标准储备液:称取经100℃干燥4h处理的核苷酸标准品(3.4)各50mg(精确至0.1mg),用水溶解,并转移至100mL容量瓶中,定容至刻度,此溶液浓度为0.5mg/mL。
3.5.2 核苷酸标准系列工作液:分别准确吸取不同体积的标准储备液(3.5.1),用水将其稀释成核苷酸含量分别为10.0μg/mL、20.0μg/mL、40.0μg/mL、80.0μg/mL、100μg/mL的标准系列工作液。临用时配制。
4 仪器和设备
4.1 液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 分析天平:感量分别为0.1mg和0.001g。
5 分析步骤
5.1 试样制备
5.1.1 不含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.45μm针孔滤膜,液相色谱仪测定。
5.1.2 含蛋白试样
称取试样适量于100mL棕色容量瓶中,加入约50℃的热水80mL,加入乙酸(3.2)100μL,彻底混匀,超声30分钟,冷却至室温后用水定容至刻度。过滤,滤液过0.45μm针孔滤膜,液相色谱仪测定。
5.2 仪器参考条件
5.2.1 高效液相色谱
色谱柱:C18柱, 250mm×4.6mm,5μm,或性能相当者。
流动相:乙腈:0.2%H3PO4水溶液=97:3(V/V)。
流速:1mL/min。
柱温:35℃。
检测波长:254nm。
进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.5.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的核苷酸标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定。
6 结果计算
试样中核苷酸测定结果按下式计算:
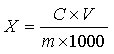
X-试样中核苷酸的含量,mg/g;
C-由标准曲线得出的试样溶液中核苷酸的浓度,μg/mL;
V-试样定容体积,mL;
m-试样称取的质量,g;
试样中总核苷酸的含量为胞嘧啶核苷(CMP)、尿嘧啶核苷(UMP)、腺嘌呤核苷(AMP)、鸟嘌呤核苷(GMP)、次黄嘌呤核苷(IMP)含量之和。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图(UPLC法)


注:G:鸟嘌呤核苷(GMP);A:腺嘌呤核苷(AMP);I:次黄嘌呤核苷(IMP)
C:胞嘧啶核苷(CMP);U:尿嘧啶核苷(UMP)
附录B
标准溶液和试样溶液典型液相色谱图(HPLC法)


注:G:鸟嘌呤核苷(GMP);A:腺嘌呤核苷(AMP);I:次黄嘌呤核苷(IMP)
C:胞嘧啶核苷(CMP);U:尿嘧啶核苷(UMP)
九、保健食品中洛伐他汀的测定
1 范围
本方法规定了保健食品中洛伐他汀的液相色谱测定方法。
本方法适用于以红曲及其加工品为原料的保健食品中内酯(闭环)洛伐他汀及酸式(开环)洛伐他汀的测定。
2 原理
试样经75%乙醇溶液超声提取,采用液相色谱分离内酯(闭环)及酸式(开环)洛伐他汀,紫外检测器检测,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 无水乙醇(CH3CH2OH)。
3.1.3 磷酸(H3PO4)。
3.1.4 氢氧化钠(NaOH)。
3.1.5 盐酸(HCl):含量:36%~38%。
3.2 试剂配制
3.2.1 75%乙醇(v/v):将无水乙醇和水按75+25的体积比混合均匀。
3.2.2 0.2mol/L氢氧化钠溶液:称取氢氧化钠1.6g,加水使溶解成200mL,即得。
3.2.3 0.2mol/L盐酸溶液:吸取盐酸1.8mL,加水适量使成100mL,即得。
3.3 标准品
洛伐他汀标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 洛伐他汀标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 洛伐他汀 | Lovastatin | 75330-75-5 | C24H36O5 | 404.54 |
3.4.1 洛伐他汀标准储备液(400μg/mL):准确称取洛伐他汀标准品40mg(精确至0.01 mg),用75%乙醇溶解并定容至100mL。
3.4.2 洛伐他汀标准系列工作液:用流动相稀释,配制浓度为8.00μg/mL、20.0μg/mL、40.0μg/mL、80.0μg/mL、160μg/mL、320μg/mL 的系列标准工作液。
3.4.3 定性用酸式(开环)洛伐他汀溶液:称取洛伐他汀(内酯)标准品4mg,用0.2mol/L氢氧化钠溶液定容至100mL,在50℃条件下超声转化1h,冷却至室温后再放置1h,用0.2mol/L 盐酸溶液调节pH至中性。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列或紫外检测器(UV)。
4.2 分析天平:感量为0.01mg和0.0001g。
4.3 超声波清洗器,功率≥250W。
4.4 涡旋混合器。
4.5 离心机:转速≥3500 r/min。
5 分析步骤
5.1 试样制备
取片剂、颗粒剂等固体样品适量,研磨均匀;胶囊剂、软胶囊剂取内容物,研磨或混匀。称取上述混匀的试样适量(相当于含洛伐他汀约5mg),精密称定,置具塞锥形瓶中,精密加入50mL 75%乙醇,密塞,称定重量,超声提取(功率250W,频率33kHz)60min,放冷,再称定重量,用75%乙醇补足减失的重量,摇匀,以3500r/min的转速离心10min,取上清液,经0.45μm微孔滤膜过滤,滤液作为试样待测液。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250mm×4.6mm ,5μm或同等性能色谱柱。
5.2.2 柱温:25℃。
5.2.3 检测波长:238nm。
5.2.4 流动相:甲醇+水+磷酸=385+115+0.14。
5.2.5 流速:1.0mL/min。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液分别注入液相色谱仪中,测得相应的峰面积,以标准系列工作液的浓度(μg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样待测液注入液相色谱仪中,以保留时间定性,测定内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀峰面积,分别代入内酯型(闭环)洛伐他汀标准曲线计算,得到待测液中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的浓度(μg/mL)。
6 结果计算
6.1 试样中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的含量分别按下式计算:
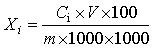
Xi—试样中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的含量,单位为克每百克(g/100g);
Ci—被测定样液中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的浓度,单位为微克每毫升(μg/mL);
V—被测定样液的最终定容体积,单位为毫升(mL);
m—试样的称样质量,单位为克(g);
100—单位转换;
1000—单位转换。
6.2 试样中洛伐他汀的总含量按下式计算:

X—试样中洛伐他汀的总含量,单位为克每百克(g/100g);
X1—试样中内酯型(闭环)洛伐他汀的含量,单位为克每百克(g/100g);
X2—试样中酸式(开环)洛伐他汀的含量,单位为克每百克(g/100g);
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图



十、保健食品中槲皮素、山柰素、异鼠李素的测定
1 范围
本方法规定了保健食品中槲皮素、山柰素、异鼠李素的液相色谱测定方法。
本方法适用于以银杏叶或银杏叶提取物为主要原料的保健食品中槲皮素、山柰素、异鼠李素的测定。
2 原理
试样经甲醇提取、酸水解等前处理后,采用液相色谱分离、紫外检测器检测,以保留时间定性,以外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 磷酸(H3PO4)。
3.1.3 盐酸(HCl):含量:36%~38%。
3.2 试剂配制
3.2.1 盐酸溶液(3.0mol/L):取盐酸25mL,加水适量使成100mL,摇匀。
3.2.2 80%甲醇溶液:将甲醇和水按80+20的体积比混合均匀。
3.3 标准品
槲皮素、山柰素、异鼠李素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 槲皮素 | Quercetin | 117-39-5 | C15H10O7 | 302.24 |
| 山柰素 | Kaempferol | 520-18-3 | C15H10O6 | 286.23 |
| 异鼠李素 | Isorhamnetin | 480-19-3 | C16H12O7 | 316.27 |
3.4.1 标准储备液(1mg/mL):分别准确称取槲皮素、山柰素、异鼠李素标准品100mg(准确至0.1mg),于100mL容量瓶中,用甲醇溶解并定容至刻度。
3.4.2 槲皮素、山柰素、异鼠李素混合标准中间液(200μg/mL):分别准确吸取槲皮素、山柰素、异鼠李素标准储备液各5.00mL于25mL容量瓶中,用流动相定容。
3.4.3 混合标准系列工作液:分别准确吸取槲皮素、山柰素、异鼠李素混合标准中间液0.50mL、1.00mL、2.00mL、3.00mL和5.00mL于10mL容量瓶中,用流动相定容至刻度,配制成质量浓度分别为10.0μg/mL、20.0μg/mL、40.0μg/mL、60.0μg/mL、100μg/mL的混合标准系列工作液。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列或紫外检测器(UV)。
4.2 分析天平:感量为0.01mg和0.0001g。
4.3 超声波清洗器:功率≥250W。
4.4 水浴锅。
5 分析步骤
5.1 试样制备
取片剂、颗粒剂等固体样品适量,研磨均匀;胶囊剂、软胶囊剂取内容物,研磨混匀。
5.1.1 槲皮素、山柰素、异鼠李素的测定
精密称取试样适量(相当于含槲皮素、山柰素、异鼠李素总量约3mg),加20mL甲醇,超声提取(功率250W,频率33kHz)30min,滤过,残渣用甲醇约5mL洗涤,洗液并入滤液,加入15mL盐酸溶液(3.0mol/L),水浴回流水解3h,冷却,转移至50mL容量瓶中,用甲醇定容至刻度,混匀,经0.45μm微孔滤膜过滤,取续滤液,作为试样待测液。
5.1.2 游离槲皮素、山柰素、异鼠李素的测定
精密称取试样适量(相当于含槲皮素、山柰素、异鼠李素总量约3mg),置具塞锥形瓶中,精密加入80%甲醇溶液20mL,密塞,称定重量,超声提取(功率250W,频率33kHz)20min,取出,放冷,再称定重量,用80%甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,作为试样待测液。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 150mm ×3.9mm ,5μm,或同等性能色谱柱。
5.2.2 柱温:25℃。
5.2.3 检测波长:360nm。
5.2.4 流动相:甲醇+0.4%磷酸溶液=50+50。
5.2.5 流速:1.0mL/min。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将10μL的混合标准系列工作液分别注入液相色谱仪中,测得相应的峰面积,以标准工作液的浓度(μg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将10μL试样待测液(5.1.1)注入液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线得到待测液中槲皮素、山柰素、异鼠李素的浓度(μg/mL);将10μL试样待测液(5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线得到待测液中游离槲皮素、山柰素、异鼠李素的浓度(μg/mL)。
6 结果计算
6.1 试样中槲皮素、山柰素、异鼠李素的含量分别按下式计算:
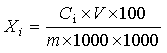
Xi—试样中槲皮素或山柰素或异鼠李素的含量,单位为克每百克(g/100g);
Ci—被测定样液中槲皮素或山柰素或异鼠李素的浓度,单位为微克每毫升(μg/mL);
V—被测定样液的最终定容体积,单位为毫升(mL);
m—试样的称样质量,单位为克(g);
100—单位转换;
1000—单位转换。
6.2 试样中槲皮素、山柰素、异鼠李素的总含量按下式计算:
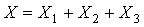
X—试样中槲皮素、山柰素、异鼠李素的总含量,单位为克每百克(g/100g);
X1—试样中槲皮素的含量,单位为克每百克(g/100g);
X2—试样中山柰素的含量,单位为克每百克(g/100g);
X3—试样中异鼠李素的含量,单位为克每百克(g/100g);
6.3 试样中银杏叶总黄酮醇苷的含量按下式计算:
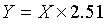
Y—试样中银杏叶总黄酮醇苷的含量,单位为克每百克(g/100g);
X—试样中槲皮素、山柰素、异鼠李素的总含量,单位为克每百克(g/100g);
2.51—换算因子。
6.4 试样中游离槲皮素、山柰素、异鼠李素的含量分别按下式计算:
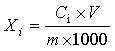
Xi—试样中游离槲皮素或游离山柰素或游离异鼠李素的含量,单位为毫克每克(mg/g);
Ci—被测定样液中游离槲皮素或游离山柰素或游离异鼠李素的浓度,单位为微克每毫升(μg/mL);
V—被测定样液的最终定容体积,单位为毫升(mL);
m—试样的称样质量,单位为克(g);
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图


十一、保健食品中茶氨酸的测定
1 范围
本方法规定了保健食品中茶氨酸的高效液相色谱测定方法。
本方法适用于红茶、绿茶等及以茶氨酸为主要原料的保健食品中茶氨酸含量的测定。
2 原理
试样经水提取,使用等度洗脱,采用配有二极管阵列检测器或紫外检测器的高效液相色谱仪检测,以保留时间定性,外标法定量。
3 试剂和材料
注:水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 三氟乙酸(CF3COOH),色谱纯。
3.2 标准品
茶氨酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 茶氨酸标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 茶氨酸 | L-theanine | 3081-61-6 | C7H14N2O3 | 174.20 |
3.3.1 茶氨酸标准储备液:称取35.0mg茶氨酸标准品(精确到0.1mg),用水溶解后,移入10mL容量瓶,用水定容至刻度,此溶液浓度为3.5mg/mL。贮存于4℃冰箱中,有效期3个月。
3.3.2 茶氨酸标准系列工作液:分别准确吸取茶氨酸标准储备液(3.3.1)0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,移入10mL容量瓶,用水定容至刻度。得到浓度分别为0.070mg/mL、0.14mg/mL、0.21mg/mL、0.28mg/mL、0.35mg/mL茶氨酸标准使用液。临用时配制。
3.4 三氟乙酸水溶液:取水加三氟乙酸(3.1.1),调至pH3.0,经微孔滤膜(3.5)过滤,待用。
3.5 微孔滤膜:0.45µm,水相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 恒温水浴锅。
4.3 离心机:转速≥8000r/min。
4.4 分析天平:感量分别为0.0001g和0.001g。
4.5 pH计。
5 分析步骤
5.1 试样制备
5.1.1 固体试样的处理:称取粉碎试样适量(精确至0.001g,相当于含茶氨酸10mg),加水30mL,在80℃的恒温水浴锅上加热40min,冷却,离心,过滤后,转移至50mL容量瓶,用水定容至刻度,混匀。试样溶液经微孔滤膜(3.5)过滤,滤液进液相色谱仪分析。
5.1.2 液体试样的处理:取一定量的试样在水浴锅上蒸干,残渣用水溶解,转移至10mL容量瓶,用水定容至刻度,混匀。试样溶液经微孔滤膜(3.5)过滤,滤液进液相色谱仪分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm ,5μm,或性能相当者。
5.2.2 流动相:三氟乙酸水溶液(3.4)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:35℃。
5.2.5 检测波长:203nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的茶氨酸标准溶液的色谱峰面积(峰高),以标准工作液的浓度为横坐标,以色谱峰的峰面积(峰高)为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液茶氨酸的色谱峰面积(峰高),根据标准曲线得到待测液中茶氨酸的浓度,平行测定次数不少于两次。
茶氨酸的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中茶氨酸含量按下式计算:
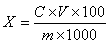
X—试样中茶氨酸的含量,单位为克每百克(g/100g);
C—由标准曲线得出的样液中茶氨酸的浓度,单位为毫克每毫升(mg/mL);
V—试样提取过程中定容体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
茶氨酸的高效液相色谱图

十二、保健食品中五味子醇甲、五味子甲素和乙素的测定
1 范围
本方法规定了保健食品中五味子醇甲、五味子甲素和乙素的高效液相色谱测定方法。
本方法适用于以北五味子为主要原料生产的保健食品中五味子醇甲、五味子甲素和乙素含量的测定。
2 原理
将试样中的五味子醇甲、五味子甲素和乙素经甲醇提取后,使用等度洗脱反相高效液相色谱进行分离,二极管阵列检测器检测,根据色谱峰的保留时间和紫外光谱图定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 甲醇(CH3OH)。
3.2 标准品
五味子醇甲、五味子甲素和乙素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 五味子醇甲、五味子甲素和乙素标准样品的中文名称、英文名称、CAS登录号、分子式相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 五味子醇甲 | Schisandrin | 7432-28-2 | C24H32O7 | 432.51 |
| 五味子甲素 | Deoxyschisandrin | 61281-38-7 | C24H32O6 | 416.51 |
| 五味子乙素 | Schisandrin B | 61281-37-6 | C23H28O6 | 400.46 |
3.3.1 五味子醇甲、五味子甲素和乙素混合标准储备液:分别准确称取五味子醇甲、五味子甲素和乙素标准样品(3.2)20mg(精确至0.01mg),用甲醇溶解,并转移至10mL容量瓶中,定容至刻度,溶液浓度分别为2mg/mL。
3.3.2 五味子醇甲、五味子甲素和乙素混合标准系列工作液:分别准确吸取不同体积的混合标准储备液(3.3.1),用甲醇将其稀释成含量分别为0.020mg/mL、0.050mg/mL、0.20mg/mL、0.50mg/mL、1.0mg/mL的标准系列工作液。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器。
4.2 超声波清洗器。
4.3 分析天平:感量分别为0.01mg和0.001g。
5 分析步骤
5.1 试样制备
准确称取粉碎后样品适量(相当于含五味子总量30mg,精确至0.001g),置20mL容量瓶中,加入甲醇(3.1.2)约18mL,超声提取20min,取出,静置待冷,加甲醇至刻度。试样溶液过0.45μm有机系滤膜,滤液进行液相色谱分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250mm×4.6mm,5μm,或同等性能色谱柱。
5.2.2 检测波长:254nm。
5.2.3 流动相:甲醇(3.1.1)+水,(77+23,v/v)。
5.2.4 流速:1.0mL/min。
5.2.5 柱温:35℃。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制五味子醇甲、五味子甲素和乙素的标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,以保留时间和紫外光谱图定性,用相应样品溶液五味子醇甲、五味子甲素和乙素的色谱峰面积,根据标准曲线得到待测液中五味子醇甲、五味子甲素和乙素的浓度,平行测定次数不少于两次。
五味子醇甲、五味子甲素和乙素的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中五味子醇甲、五味子甲素和乙素的含量按下式计算:
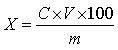
X—试样中五味子醇甲、五味子甲素和乙素的含量,单位为毫克每一百克(mg/100g);
C—试样溶液中五味子醇甲、五味子甲素和乙素的浓度,单位为毫克每毫升(mg/mL);
V—试样定容体积,单位为毫升(mL);
m—试样质量,单位为克(g)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
五味子醇甲、五味子甲素和乙素的高效液相色谱图

注:1为五味子醇甲;2为五味子甲素;3为五味子乙素
十三、保健食品中腺苷的测定
1 范围
本方法规定了保健食品中腺苷的高效液相色谱测定方法。
本方法适用于保健食品中腺苷的含量测定。
2 原理
试样经水超声提取,用高效液相色谱仪进行测定,以保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 磷酸二氢钾(KH2PO4)。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 硅藻土(SiO2):化学纯,粒径范围:0.2-0.8mm。
3.2 标准品
腺苷标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1腺苷标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 腺苷 | Adenosine | 58-61-7 | C10H13N5O4 | 267.24 |
3.3.1 腺苷标准储备液:称取10mg (准确至0.01mg)腺苷标准品(3.2)于10mL 容量瓶中,用水溶解并定容至刻度,摇匀。此溶液浓度为1.0mg/mL。
3.3.2 腺苷标准中间液:准确吸取腺苷标准储备液(3.3.1)2.5mL于25mL容量瓶中,用水稀释至刻度,摇匀。此溶液浓度为100μg/mL。
3.3.3 腺苷标准系列工作液:分别准确吸取腺苷标准中间液(3.3.2)0.1mL、0.2mL、0.5mL、1.0mL、2.0mL、5.0mL于10mL容量瓶中,用水稀释至刻度,摇匀,得浓度分别为1.0μg/mL、2.0μg/mL、5.0μg/mL、10μg/mL、20μg/mL、50μg/mL的标准系列工作液。临用时配制。
3.4 磷酸二氢钾溶液(0.01mol/L):称取1.36g磷酸二氢钾(3.1.1),加水溶解并稀释至1000mL,经微孔滤膜(3.5)过滤,待用。
3.5 微孔滤膜:0.45µm,水相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 超声波提取器:功率250W,频率33kHz。
4.3 分析天平:感量0.01mg、0.0001g和0.001g。
4.4 离心机:转速≥3000 r/min。
5 分析步骤
5.1 试样制备
5.1.1 试样提取
5.1.1.1 固体试样
准确称取粉碎并混合均匀的试样0.5g~2g(精确至0.0001g,含待测组分约0.05mg ~2.5mg)于50mL容量瓶中,加入水约30mL,超声提取20min,放至室温,用水稀释至刻度,摇匀,以3000 r/min离心5min。再经微孔滤膜(3.5)过滤,取续滤液进液相色谱仪分析。
5.1.1.2 软胶囊试样
取软胶囊剪开,挤出内容物并混匀,准确称取2g(精确至0.0001g),准确加入等量硅藻土(3.1.3),研至分散均匀,准确称取其中部分(准确至0.0001g,含待测组分约0.05mg ~2.5mg),转移至250mL具塞三角瓶中,并吸取50.0mL水,并入三角瓶中,称重(准确至0.001g),加塞超声提取20min,放至室温,用水补足重量,摇匀,静置澄清或以3000r/min离心5min。取上清液,再经微孔滤膜(3.5)过滤,取续滤液进液相色谱仪分析。
5.1.1.3 液体试样
准确吸取混匀的试样5.0mL~10.0mL(含待测组分约0.05mg ~2.5mg)于50mL容量瓶中,加入水约30mL,超声提取20min,放至室温,用水稀释至刻度,摇匀,以3000r/min离心5min。再经微孔滤膜(3.5)过滤,取续滤液进液相色谱仪分析。
5.1.2 试样溶液稀释
必要时,根据上述试样溶液中腺苷的含量,用水进行适当的稀释(稀释倍数F),使待测溶液中腺苷浓度在1.0μg/mL~50μg/mL范围内。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm ,5μm,或性能相当者。
5.2.2 流动相:甲醇(3.1.2)+磷酸二氢钾溶液(3.4),(10+90,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:35℃。
5.2.5 检测波长:254nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.3)分别按液相色谱参考条件(5.2)进行测定,得到相应的腺苷标准溶液的色谱峰面积,以标准系列工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将待测溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的待测溶液腺苷的色谱峰面积,根据标准曲线得到待测液中腺苷的浓度,平行测定次数不少于两次。
腺苷的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中腺苷含量按下式计算:
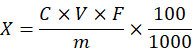
X—试样中腺苷的含量,固体和软胶囊试样的单位为毫克每百克(mg/100g),液体试样的单位为毫克每百毫升(mg/100mL);
C—根据标准曲线计算得到的待测溶液中腺苷的浓度,单位为微克每毫升(μg/mL);
V—试样提取时的定容体积,单位为毫升(mL);
F—稀释倍数;
m—试样称取的质量,单位为克(g);或液体试样吸取的体积,单位为毫升(mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录A
腺苷的高效液相色谱图

十四、保健食品中总皂苷的测定
1 范围
本方法规定了保健食品中总皂苷的分光光度测定方法。
本方法适用于含五加科原料保健食品中总皂苷含量的测定。
第一法
2 原理
试样用水提取总皂苷类成分,过大孔树脂柱除杂后,试样中的皂苷类成分在高氯酸的作用下与香草醛反应,产生特征的紫红色,采用分光光度法测定560nm波长处的吸光度,进行定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682 规定的一级水。
3.1 试剂
3.1.1 Amberlite-XAD-2 大孔树脂(或D-101大孔树脂):20~60目,使用前应按照使用说明书进行活化处理。
3.1.2 中性氧化铝:层析用(100-200目)。
3.1.3 无水乙醇(CH3CH2OH)。
3.1.4 甲醇(CH3OH)。
3.1.5 高氯酸(HClO4)。
3.1.6 冰乙酸(CH3COOH)。
3.1.7 香草醛(C8H8O3)。
3.2 标准品
人参皂苷Re标准样品的分子式、相对分子量、CAS登录号见表1,或经国家认证并授予标准物质证书的标准物质。
表1 人参皂苷Re标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 人参皂苷Re | Ginsenoside Re | 52286-59-6 | C48H82O18 | 947.15 |
人参皂苷Re标准储备液(0.2mg/mL):准确称取人参皂苷Re标准样品(3.2)10mg(精确至0.01mg)于50mL容量瓶中,用甲醇溶解并定容至刻度,摇匀。
3.4 试剂配制
3.4.1 70%乙醇:取无水乙醇70mL,加水使成100mL,混匀。
3.4.2 香草醛溶液:称取5g香草醛,加冰乙酸溶解并定容至100mL,混匀。
4 仪器和设备
4.1 紫外/可见分光光度计。
4.2 天平:感量分别为0.01mg和0.001g。
4.3 超声波清洗器。
4.4 恒温水浴锅。
5 分析步骤
5.1 试样制备
5.1.1 试样处理
5.1.1.1 固体试样
称取已粉碎混合均匀的待测试样1g(精确至0.001g)(或根据试样含总皂苷量而定),置于具塞锥形瓶中,加入水100.0mL,称重,超声30min,放冷,再用水补足减失重量,摇匀,放置,滤过,续滤液备用。
5.1.1.2 液体试样
含乙醇的液体试样,吸取混合均匀的待测试样10.0mL(或根据试样含总皂苷量而定)置水浴上挥尽乙醇后,用水转移至10mL容量瓶中,并用水稀释至刻度,备用;非乙醇类的液体试样,直接取样。
5.1.2 柱层析法
在内径为1.5cm的玻璃层析柱内装3cm已活化的大孔树脂(3.1.1),上加1cm中性氧化铝(3.1.2)。先用25mL70%乙醇(3.4.1)洗柱,弃去洗脱液,再用约25mL水洗脱至无醇味,弃去洗脱液,加入1.0mL已处理好的试样溶液(5.1.1),用25mL水洗脱,弃去洗脱液,再用25mL 70%乙醇(3.4.1)以不超过3mL/min的速度洗脱人参皂苷至洗脱液无色,收集洗脱液于蒸发皿中,置于60℃水浴挥干,残渣用少量甲醇(3.1.4)溶解并转移至10mL具塞比色管中,备用。
5.2 标准曲线的制作
吸取人参皂苷Re标准溶液(3.3)0.0mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL于10mL具塞比色管中,置水浴中挥干溶剂,加入0.2mL香草醛溶液(3.4.2),再加入0.8mL高氯酸(3.1.5),混匀,使残渣全部溶解,置60℃水浴中加热10min,取出,冰浴冷却后,加入5.0mL冰乙酸(3.1.6),摇匀后,以相应试剂为空白,立即于560nm波长处测定吸光度。
5.3 试样溶液的测定
取5.1.2项下备用溶液 ,从5.2置水浴中挥干溶剂……”起,与标准溶液同法测定吸光度。
6 结果计算
试样中总皂苷含量(以人参皂苷Re计)按下式计算:
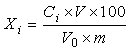
Xi—试样中总皂苷的含量(以人参皂苷Re计),单位为毫克每百克(mg/100g)或毫克每百毫升(mg/100mL);
Ci—由标准曲线算得被测液中人参皂苷Re质量,单位为毫克(mg) ;
V—被测样品的稀释体积,单位为毫升(mL);
V0—用于柱层析的样液体积,单位为毫升(mL);
m—试样取样量,单位为克(g)或毫升(mL);
100—单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10% 。
第二法
8 原理
试样用水提取总皂苷类成分,经水饱和正丁醇萃取除杂后,试样中的皂苷类成分在高氯酸的作用下与香草醛反应,产生特征的紫红色,采用分光光度法测定560nm波长处的吸光度,进行定量。
9 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682 规定的一级水。
9.1 试剂
9.1.1 甲醇(CH3OH)。
9.1.2 石油醚:沸程(60~90℃)。
9.1.3 正丁醇(CH3(CH2)2CH2OH)。
9.1.4 无水乙醇(CH3CH2OH)。
9.1.5 氨水(NH3.H2O)。
9.1.6 高氯酸(HClO4)。
9.1.7 冰乙酸 (CH3COOH)。
9.1.8 香草醛(C8H8O3)。
9.2 标准品
人参皂苷Re标准样品:同3.2。
9.3 标准溶液配制
人参皂苷Re标准储备液(0.2 mg/mL):同3.3。
9.4 试剂配制
9.4.1 香草醛溶液:同3.4.2。
9.4.2 水饱和正丁醇溶液:取正丁醇适量,加入适量水,充分振摇,静置使分层,上层液体即为水饱和正丁醇。
9.4.3 氨试液:取氨水40mL,加水使成100mL,混匀。
10 仪器和设备
10.1 紫外/可见分光光度计。
10.2 天平:感量为0.01mg和0.001g。
10.3 超声波清洗器。
10.4 离心机:转速 ≥4000r/min。
10.5 恒温水浴锅。
11 分析步骤
11.1 试样制备
11.1.1 试样处理
11.1.1.1 固体试样
称取已粉碎混合均匀的待测试样1g(精确至0.001g)(或根据试样含总皂苷量定),置于具塞锥形瓶中,加入水100.0mL,称重,超声30min,放冷,再用水补足减失重量,摇匀,放置,滤过,续滤液备用。
11.1.1.2 液体试样
含乙醇的液体试样,吸取混合均匀的待测试样10.0mL(或根据试样含总皂苷量而定)置水浴上挥尽乙醇后,用水转移至10mL容量瓶中,并用水稀释至刻度,备用;非乙醇类的液体试样,直接取样。
11.1.1.3 含油基质试样
称取已混合均匀的待测试样0.5g(或根据试样含总皂苷量而定)置于100mL离心管中,加入20mL石油醚(9.1.2),涡旋混合1min,4000r/min离心5min,弃去上清液,残渣挥干石油醚后,加入水50.0mL,称重,超声30min,放冷,再用水补足减失重量,摇匀,放置,滤过,续滤液备用。
11.1.2 萃取除杂
取11.1.1.1、11.1.1.3项下备用溶液25.0mL置分液漏斗中;或将11.1.1.2项下备用溶液用水全部转移至分液漏斗中(非乙醇类液体试样直接取10.0mL)并加水至约25mL。加入20mL水饱和正丁醇(9.4.2)振摇萃取,分取正丁醇液(必要时可离心),重复操作3次,合并正丁醇液用20mL氨试液(9.4.3)洗涤,重复操作2次,弃去氨试液,以适宜方式(水浴、减压或氮吹)除去正丁醇液后,残渣用甲醇(9.1.1)溶解并转移至25mL量瓶中(液体样品则转移至10mL量瓶中),加甲醇定容至刻度,摇匀,滤过,取续滤液,备用。
11.2 标准曲线的制作
吸取人参皂苷Re标准溶液(9.3)0.0mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL于10mL具塞比色管中,置水浴中挥干溶剂,加入0.2mL香草醛溶液(9.4.1),再加入0.8mL高氯酸(9.1.6),混匀,使残渣全部溶解,置60℃水浴中加热10min,取出,冰浴冷却后,加入5.0mL冰乙酸(9.1.7),摇匀后,以相应试剂为空白,立即于560nm波长处测定吸光度。
11.3 试样溶液的测定
取11.1.2项下备用溶液1.0mL于10mL具塞比色管中,从11.2 “置水浴中挥干溶剂……”起,与标准溶液同法测定吸光度。
11.4 背景校正(如样品不存在背景干扰,无需校正)
吸取11.1.2项下备用溶液1.0mL于10mL具塞比色管中,置水浴中挥干溶剂,加入0.2mL冰乙酸(9.1.7),从11.2 “再精密加入0.8 mL高氯酸(9.1.6)……”起,与试样同法测定吸光度,做试样背景校正。
12 结果计算
试样中总皂苷含量(以人参皂苷Re计)按下式计算:
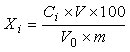
Xi—试样中总皂苷的含量(以人参皂苷Re计),单位为毫克每百克(mg/100g)或毫克每百毫升(mg/100mL);
Ci—经试样背景校正后,由标准曲线算得被测液中人参皂苷Re质量,单位为毫克(mg) ;
V—被测样品的稀释体积,单位为毫升(mL);
V0—用于显色的样液体积,单位为毫升(mL);
m—试样取样量,单位为克(g)或毫升(mL);
100—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
13 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10% 。
十五、保健食品中总黄酮的测定
1 范围
本方法规定了保健食品中总黄酮的分光光度测定方法。
本方法适用于以含黄酮类成分为主要原料的保健食品中总黄酮含量的测定。
第一法
2 原理
试样中的总黄酮经乙醇提取、聚酰胺粉吸附、甲苯和甲醇洗脱净化后,以芦丁为对照样品,采用分光光度法在360nm波长下测定总黄酮的吸光度,标准曲线法进行定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水或三级水。
3.1 试剂
3.1.1乙醇(C2H5OH)。
3.1.2聚酰胺粉。
3.1.3甲苯(C7H8)。
3.1.4甲醇(CH3OH)。
3.2 标准品
芦丁标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥90%,或经国家认证并授予标准物质证书的标准物质。
表1 芦丁标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 芦丁 | Rutoside | 153-18-4 | C27H30O16 | 610.52 |
3.3.1芦丁标准储备液:称取在102℃烘箱中恒重后的芦丁标准样品(3.2)5.0mg(精确至0.01mg),加甲醇溶解,并转移至100mL容量瓶中定容至刻度,此溶液浓度为50μg/mL。
3.3.2芦丁标准系列工作液:精密吸取0.0、1.0、2.0、3.0、4.0、5.0mL的标准储备液(3.3.1),分别置于10mL容量瓶中,加甲醇至刻度,摇匀,制成芦丁浓度分别为0.0μg/mL、5.0μg/mL、10μg/mL、15μg/mL、20μg/mL、25μg/mL的标准系列工作液。
4 仪器和设备
4.1 紫外/可见分光光度计。
4.2 超声波清洗器。
4.3 层析柱。
4.4 分析天平:感量分别为0.01mg、0.0001g和0.001g。
5 分析步骤
5.1 试样制备
称取一定量的试样,加乙醇(3.1.1)定容至25mL,摇匀,超声提取20min,放置,吸取上清液1.0mL,于蒸发皿中,加1g聚酰胺粉(3.1.2)吸附,水浴挥去乙醇,然后转入层析柱(层析柱内径可根据每个产品具体情况确定)。先用20mL甲苯(3.1.3)洗脱,弃去甲苯液;然后用甲醇(3.1.4)洗脱,合并洗脱液并定容至25mL,即得。
5.2 标准曲线的制作
取标准系列工作液(3.3.2),于波长360nm测定吸光度,以芦丁标准工作液的浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
5.3 试样溶液的测定
取试样溶液(5.1),于波长360nm测定吸光度,根据标准曲线得到试样溶液中总黄酮的浓度,平行测定次数不少于两次。
6 结果计算
试样中总黄酮含量按下式计算:
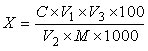
X—试样中总黄酮的含量,以芦丁(C27H30O16)计, 单位为克每一百克或克每一百毫升(g/100g或g/100mL);
C—试样溶液中总黄酮的浓度,单位为毫克每毫升(mg/mL);
V1—试样定容体积,单位为毫升(mL);
V2—吸取试样溶液体积,单位为毫升(mL);
V3—过柱后定容体积,单位为毫升(mL);
M—试样取样量,单位为克或毫升(g或mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
第二法
8 原理
试样经预处理除杂后,以甲醇或60%乙醇溶液提取黄酮类成分。试样中的黄酮类成分可被亚硝酸钠还原,与硝酸铝生成络合物,在氢氧化钠溶液碱性条件下开环,生成2-羟基查尔酮而使溶液显特征的橙红色,采用分光光度法在510nm波长处测定吸光度,以芦丁为对照品,采用标准曲线法计算样品中总黄酮的含量。
9 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水或三级水。
9.1 试剂
9.1.1 亚硝酸钠(NaNO2)。
9.1.2 硝酸铝(Al(NO3)3·9H2O)。
9.1.3 氢氧化钠(NaOH)。
9.1.4 石油醚(60~90℃)。
9.1.5 无水乙醇(CH3CH2OH)。
9.1.6 甲醇(CH3OH)。
9.2 试剂配制
9.2.1 5%亚硝酸钠溶液:称取5.0g亚硝酸钠(9.1.1),加水溶解成100mL。
9.2.2 10%硝酸铝溶液:称取硝酸铝(9.1.2)17.6g,加水溶解成100mL。
9.2.3 氢氧化钠试液:称取氢氧化钠(9.1.3)4.3g,加水溶解成100mL。
9.2.4 60%乙醇:量取无水乙醇(9.1.5)60mL,加水至100mL。
9.3 标准品
芦丁标准样品:同3.2。
9.4 标准溶液配制
9.4.1 芦丁标准储备液:准确称取在102℃烘箱中恒重后的芦丁标准样品(9.3)20mg(精确至0.01 mg),加甲醇溶解,并转移至100mL容量瓶中,定容至刻度,此溶液浓度为0.2mg/mL。
10 仪器和设备
10.1 紫外/可见分光光度计。
10.2 超声波清洗器。
10.3 离心机。
10.4 索氏提取器。
10.5分析天平:感量分别为0.01mg、0.0001g和0.001g。
11 分析步骤
11.1 试样制备
注:试样取样量、供试液取样体积可根据试样中总黄酮的含量适当调整,以保证测定的吸光度值在0.3~0.7范围内。
11.1.1 含油脂类固体样品与软胶囊:精密称取含油脂类固体样品或软胶囊内容物0.4g,置索氏提取器中,加石油醚(9.1.4)加热回流提取至提取液无色,弃去石油醚液,样渣挥去石油醚,转移至具塞锥形瓶中,精密加甲醇(9.1.6)25mL,密塞,称定重量,超声处理30min,放冷至室温,称定重量,用甲醇补足减失的重量,摇匀,离心,取上清液作为供试品溶液。
11.1.2 不含油脂类固体样品:精密称取适量,置于具塞锥形瓶中,精密加甲醇(9.1.6)25mL,密塞,称定重量,超声处理30min,放冷至室温,称定重量,用甲醇补足减失的重量,摇匀,离心,取上清液作为供试品溶液。
11.1.3 液体试样:精密吸取供试品2mL,置于25mL容量瓶中,加60%乙醇(9.2.4)溶解并稀释至刻度,摇匀,作为供试品溶液。
11.2 标准曲线的制作
精密吸取0.0、1.0、2.0、3.0、4.0、5.0、6.0mL的芦丁标准储备液(9.4.1),分别置于25mL容量瓶中,加水至6mL,加入5%亚硝酸钠溶液(9.2.1)1mL,摇匀,放置6min,加10%硝酸铝溶液(9.2.2)1mL,摇匀,放置6min,加氢氧化钠试液(9.2.3)10mL,摇匀,再加水至刻度,摇匀,放置15min,制成芦丁浓度分别为0.0μg/mL、 8.0μg/mL、16μg/mL、24μg/mL、32μg/mL、40μg/mL、48μg/mL的标准系列工作液。以0.0mL标准储备液制得的溶剂为空白,在波长510nm处分别测定吸光度值。以吸光度为纵坐标,对照品浓度为横坐标,绘制标准曲线。
11.3 试样溶液的测定
精密吸取供试品溶液(11.1)2mL,至25mL容量瓶中;照11.2,自加水至6mL起,……,至在510nm波长处测定吸光度,同法操作。从标准曲线上读出供试品溶液中含总黄酮的浓度,计算样品中总黄酮的含量。
12 结果计算
试样中总黄酮含量按下式计算:
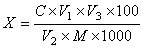
X—试样中总黄酮的含量,以芦丁(C27H30O16)计, 单位为克每一百克或克每一百毫升(g/100g或g/100mL);
C—标准曲线上读出供试品溶液中总黄酮的浓度,单位为毫克每毫升(mg/mL);
V1—试样定容体积,单位为毫升(mL);
V2—吸取试样溶液体积,单位为毫升(mL);
V3—显色定容体积,单位为毫升(mL);
M—试样取样量,单位为克或毫升(g或mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
13 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的:15%(固体样品)、10%(液体样品)。
注:样品有颜色时,可采用样品标准添加法,以0号管调零,绘制标准曲线,以消除样品颜色干扰。
十六、保健食品中壳聚糖脱乙酰度的测定
1 范围
本方法规定了保健食品中壳聚糖脱乙酰度的碱量法测定方法。
本方法适用于保健食品中壳聚糖脱乙酰度的测定。
2 原理
用盐酸溶液溶解试样,溶液中游离的H+用氢氧化钠标准滴定溶液滴定,以甲基橙-苯胺蓝作指示液,通过消耗的氢氧化钠的量计算试样中氨基的含量,从而得到试样中壳聚糖脱乙酰度。
3 试剂和材料
注:水为GB/T 6682规定的一级水。
3.1 试剂配制
3.1.1 盐酸标准滴定溶液:c(HCl)=0.1mol/L。按照GB/T 601标准要求配制和标定,也可购买市售商品化试剂。
3.1.2 氢氧化钠标准滴定溶液:c(NaOH)=0.1mol/L。按照GB/T 601标准要求配制和标定,也可购买市售商品化试剂。
3.1.3 甲基橙-苯胺蓝指示液:甲基橙溶液(1g/L)与苯胺蓝溶液(1g/L)以1:2体积比混合。
4 仪器和设备
分析天平:感量为0.0001g。
5 分析步骤
5.1 试样制备
准确称取于105℃±2℃烘干至恒重的试样0.2g,精确至0.0001g,加入30mL盐酸标准滴定溶液,搅拌至完全溶解,加入2滴~3滴甲基橙-苯胺指示液。
5.2 滴定
用氢氧化钠标准滴定溶液滴定5.1中得到的溶液,滴定使溶液颜色由紫红色变为蓝绿色为止,记录消耗氢氧化钠标准滴定溶液的体积。
6 结果计算
试样中壳聚糖脱乙酰度W按下式计算:
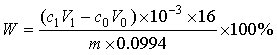
c 1—盐酸标准滴定溶液的浓度,单位为摩尔每升(mol/L);
V1—加入盐酸标准滴定溶液的体积,单位为毫升(mL);
c 0—氢氧化钠标准滴定溶液的浓度,单位为摩尔每升(mol/L);
V0—滴定用氢氧化钠标准滴定溶液的体积,单位为毫升(mL);
10-3—单位换算系数;
16—氨基的摩尔质量,单位为克每摩尔(g/mol);
m—试样中壳聚糖的质量,单位为克(g);
0.0994—理论氨基含量(16/161)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。
十七、保健食品中总蒽醌的测定
1 范围
本方法规定了保健食品中总蒽醌的分光光度测定方法。
本方法适用于保健食品中总蒽醌的测定。
2 原理
试样经酸水解后,以有机溶剂提取总蒽醌,利用羟基蒽醌衍生物在碱性溶液中显红-紫红色反应(Borntrager反应),采用分光光度法,以标准曲线定量检测。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的三级水。
3.1 试剂
3.1.1 盐酸(HCl):含量:36%~38%。
3.1.2 氨水(NH3·H2O)。
3.1.3 二氯甲烷(CH2Cl2)。
3.1.4 氢氧化钠(NaOH)。
3.1.5 甲醇(CH3OH)。
3.2 标准品
1,8-二羟基蒽醌标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99.0%,或经国家认证并授予标准物质证书的标准物质。
表1 1,8-二羟基蒽醌标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 1,8-二羟基蒽醌 | 1,8-Dihydroxyanthraquinone | 117-10-2 | C14H8O4 | 240.21 |
1,8-二羟基蒽醌标准溶液:精密称取1,8-二羟基蒽醌标准样品10mg(精确至0.01mg),置25mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成0.4mg/mL的溶液。
3.4 试剂配制
3.4.1 4%氨溶液:取氨水16mL,加水稀释至100mL。
3.4.2 10%氢氧化钠溶液:称取氢氧化钠10g,加水溶解并定容至100mL。
3.4.3 混合碱溶液:等体积10%氢氧化钠溶液和4%氨溶液混合。
3.4.4 甲醇-盐酸(10:1)混合溶液:取甲醇100mL,加盐酸10mL,混合均匀。
4 仪器和设备
4.1 分光光度计
4.2 分析天平:感量分别为0.01mg和0.0001g。
4.3 恒温水浴锅
4.4 旋转蒸发仪
5 分析步骤
5.1 标准曲线的制作
分别精密吸取1,8-二羟基蒽醌标准溶液0.00mL、0.10mL、0.20mL、0.40mL、0.60mL、0.80mL、1.00mL于25mL容量瓶中,加混合碱溶液至刻度,混匀,于暗处放置30分钟。以混合碱溶液为空白,在525nm波长处,分别测定吸光度。以浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
5.2 试样溶液的测定
精密取混合均匀的待测试样适量(相当于含总蒽醌2mg~17mg),置100mL圆底烧瓶中,精密加入甲醇-盐酸(10:1)混合溶液25mL,称重,在80℃水浴中加热回流30分钟,放冷,用甲醇补足减失的重量,摇匀,滤过,弃去初滤液,精密量取续滤液15mL至分液漏斗中,加水25mL,用二氯甲烷萃取3次(50mL、40mL、30mL),合并提取液,并用水洗涤3次,每次40mL,洗涤至中性,弃去水洗液,二氯甲烷层转移至蒸发皿中水浴蒸干,或转移至圆底烧瓶于40℃水浴中减压蒸馏至干,残渣加甲醇使溶解并转移至10mL容量瓶中,用甲醇定容至刻度,摇匀。精密量取2mL,置25mL容量瓶中,加混合碱溶液至刻度,混匀,作为待测液。该溶液于暗处放置30分钟,以混合碱溶液为空白,在525nm波长处,测定吸光度(如果待测液浑浊,可过滤或离心后测定吸光度)。根据回归方程计算试样中总蒽醌的含量。
6 结果计算
试样中总蒽醌含量按下式计算:
V1×V3×V5×100
X= C×————————
V2×V4×m
式中:
X——试样中总蒽醌的含量,单位为毫克每百克(mg/100g);
C——由标准曲线查得测定试样中总蒽醌的浓度,单位为毫克每毫升(mg/mL);
V1——试样酸解时的稀释体积(mL);
V2——用二氯甲烷萃取时吸取的酸解液体积(mL);
V3——残渣溶解后的体积(mL);
V4——混合碱显色时吸取的甲醇溶液的体积(mL);
V5——混合碱显色的定容体积(mL);
m——试样的称样质量,单位为克(g);
100——单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
十八、保健食品中10-羟基-2-癸烯酸的测定
1 范围
本方法规定了保健食品中10-羟基-2-癸烯酸的高效液相色谱测定方法。
本方法适用于保健食品中10-羟基-2-癸烯酸的含量测定。
2 原理
试样经乙醇或甲醇提取后,用高效液相色谱进行测定,以保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。
3.1 试剂
3.1.1 磷酸(H3PO4)。
3.1.2 盐酸(HCl):含量:36%~38%。
3.1.3 甲醇(CH3OH):色谱纯。
3.1.4 无水乙醇(C2H6O)。
3.1.5 硅藻土(SiO2):化学纯,粒径范围:0.2~0.8mm。
3.2 标准品
10-羟基-2-癸烯酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 10-羟基-2-癸烯酸标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 10-羟基-2-癸烯酸 | 10-hydroxy-2-decenoic acid | 14113-05-4 | C10H18O3 | 186.25 |
3.3.1 10-羟基-2-癸烯酸标准储备液:称取10mg(准确至0.01mg)10-羟基-2-癸烯酸标准品(3.2)于10mL 容量瓶中,用无水乙醇(3.1.4)溶解并定容至刻度,摇匀。此溶液浓度为1.0 mg/mL。
3.3.2 10-羟基-2-癸烯酸标准系列工作液:分别准确吸取10-羟基-2-癸烯酸标准储备液(3.3.1)0.02mL、0.10mL、0.20mL、0.50mL、1.00mL 于 10.0mL容量瓶中,用无水乙醇(3.1.4)稀释至刻度,摇匀,得浓度分别为2.0μg/mL、10.0μg/mL、20.0μg/mL、50.0μg/mL、100μg/mL的标准系列工作液。
3.4 盐酸溶液(0.01mol/L):准确吸取盐酸(3.1.2)0.9mL,缓慢加入1000mL水,混匀。
3.5 微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
4.2 分析天平:感量分别为0.01mg、0.0001g和0.001g。
4.3 离心机:转速≥3000r/min。
4.4 超声波清洗器:功率250W,频率33kHz。
5 分析步骤
5.1 试样制备
5.1.1 试样提取
5.1.1.1 固体试样
准确称取粉碎并混合均匀的试样0.5g~2g(准确至0.0001g,含待测组分约0.1 mg ~5 mg)于50mL容量瓶中,吸取盐酸溶液(3.4)2.0mL,量取无水乙醇(3.1.4)30mL,超声提取20min,放至室温,用无水乙醇(3.1.4)稀释至刻度,摇匀,3000r/min离心10min。取上清液经0.45μm微孔滤膜(3.5)过滤后,取续滤液供液相色谱分析用。
5.1.1.2 软胶囊试样
取软胶囊剪开,挤出内容物并混匀,准确称取2g(准确至0.0001g)后,准确加入等量硅藻土(3.1.5),研至分散均匀,准确称取其中部分(准确至0.0001g,含待测组分约0.1mg~5mg),转移至250mL具塞三角瓶中,分别吸取盐酸溶液(3.4)2.0mL、无水乙醇(3.1.4)48 mL,并入三角瓶中,称重(准确至0.001g),加塞超声提取20min,放至室温,用无水乙醇(3.1.4)补足重量,摇匀,静置澄清或取部分混悬液3000r/min离心10min。取上清液经0.45μm微孔滤膜(3.5)过滤后,取续滤液供液相色谱分析用。
5.1.1.3 液体试样
准确吸取混匀的试样5.0mL~10.0mL(含待测组分约0.1mg ~5mg)于50mL容量瓶中,加甲醇(3.1.3)30mL,超声提取20min,放至室温,用甲醇(3.1.3)稀释至刻度,摇匀,3000r/min离心10min。取上清液经0.45μm微孔滤膜(3.5)过滤后,取续滤液供液相色谱分析用。
5.1.2 试样溶液稀释
必要时,根据试样溶液中10-羟基-2-癸烯酸的含量,用相应溶剂进行适当的稀释(稀释倍数F),使待测溶液中10-羟基-2-癸烯酸浓度在2.0μg/mL~100.0μg/mL范围内。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250mm×4.6mm,5μm,或性能相当者。
5.2.2 流动相:甲醇(3.1.3)+水+磷酸(3.1.1),(55+45+0.2,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:35℃。
5.2.5 检测波长:210nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将10-羟基-2-癸烯酸标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的色谱峰面积。以标准系列工作液的浓度为横坐标,以色谱峰面积为纵坐标,绘制标准曲线。
10-羟基-2-癸烯酸标准溶液液相色谱图参见附录A中图A.1。
5.4 待测溶液的测定
将待测溶液(5.1)按液相色谱参考条件(5.2)进行测定,以保留时间定性,得到待测溶液中10-羟基-2-癸烯酸的色谱峰面积,根据标准曲线计算待测溶液中10-羟基-2-癸烯酸的浓度,平行测定次数不少于两次。
待测溶液液相色谱图参见附录A中图A.2。
6 结果计算
试样中10-羟基-2-癸烯酸含量按下式计算:
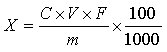
X—试样中10-羟基-2-癸烯酸的含量,固体和软胶囊试样单位为毫克每百克(mg/100g),液体试样为毫克每百毫升(mg/100mL);
C—根据标准曲线计算得到的待测溶液中10-羟基-2-癸烯酸的浓度,单位为微克每毫升(μg/mL);
V—试样提取时的定容体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);或液体试样吸取的体积,单位为毫升(mL);
F—稀释倍数;
100—单位换算;
1000—单位换算。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录 A
标准溶液和待测溶液典型高效液相色谱图


十九、保健食品中绞股蓝皂苷XL IX的测定
1 范围
本方法规定了保健食品中绞股蓝皂苷XL IX的高效液相色谱测定方法。
本方法适用于以绞股蓝及其加工品为主要原料的保健食品中绞股蓝皂苷XL IX含量的测定。
2 原理
试样经甲醇提取后,采用配有二极管阵列检测器或紫外检测器的高效液相色谱仪检测,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。
3.1 试剂
3.1.1 乙腈(CH3CN):色谱纯。
3.1.2 甲醇(CH3OH):分析纯。
3.2 标准品
绞股蓝皂苷XL IX标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99%,或经国家认证并授予标准物质证书的标准物质。
表1 绞股蓝皂苷XL IX标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 绞股蓝皂苷XL IX | Gypenoside XL IX | 94987-08-3 | C52H86O21 | 1047.22 |
3.3.1 绞股蓝皂苷XL IX标准储备液:称取在60±5℃,40kpa~53kpa条件下减压干燥3h的绞股蓝皂苷XL IX标准样品(3.2)0.025g(精确至0.0001g),用甲醇(3.1.2)溶解,并转移至5mL容量瓶中,定容至刻度,此溶液浓度为5mg/mL。贮存于-18℃冰箱中,有效期3个月。
3.3.2 绞股蓝皂苷XL IX标准系列工作液:分别准确吸取不同体积的标准储备液(3.3.1),用甲醇将其稀释成绞股蓝皂苷XL IX含量分别为0.005mg/mL、0.01mg/mL、0.02mg/mL、0.10mg/mL、0.50mg/mL的标准系列工作液。也可依仪器响应情况配制适当浓度的标准工作溶液。标准工作溶液需临用时配制。
3.4微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 超声波清洗器。
4.3 分析天平:感量分别为0.0001g和0.001g。
5 分析步骤
5.1 试样制备
5.1.1固体试样
取20粒以上片剂或胶囊试样进行粉碎、混匀,或取半固态试样混匀(软胶囊称取内容物),准确称取0.5g试样(精确至0.001g)于10mL具塞刻度试管中,加入甲醇8mL,混匀,超声5min后,冷却至室温,用甲醇定容至刻度,混匀,经微孔滤膜(3.4)过滤,取续滤液进液相色谱仪分析。
5.1.2 液体试样
准确称取摇匀的试样0.5mL于10mL容量瓶中,加入甲醇8mL,混匀,超声5min后,冷却至室温,用甲醇定容至刻度,混匀,经微孔滤膜(3.4)过滤,取续滤液进液相色谱仪分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,100mm×4.6mm,3μm,或性能相当者。
5.2.2 流动相A:乙腈(3.1.1),流动相B:水,梯度洗脱条件见表2。
表2 梯度洗脱条件
| 时间(min) | A相/ % | B相/ % |
| 0 | 25 | 75 |
| 15 | 35 | 65 |
| 35 | 45 | 55 |
| 40 | 45 | 55 |
| 41 | 25 | 75 |
5.2.4 柱温:40℃。
5.2.5 检测波长:203nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的绞股蓝皂苷XL IX标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的待测溶液绞股蓝皂苷XL IX的色谱峰面积,根据标准曲线得到待测液中绞股蓝皂苷XL IX的浓度,平行测定次数不少于两次。
绞股蓝皂苷XL IX的标准溶液液相色谱图参见附录A的图A.1。
绞股蓝皂苷XL IX的试样溶液液相色谱图参见附录A的图A.2。
6 结果计算
试样中绞股蓝皂苷XL IX含量按下式计算:

X—试样中绞股蓝皂苷XL IX的含量,单位为克每百克(g/100g)或克每百毫升(g/100mL);
C—由标准曲线得出的样液中绞股蓝皂苷XL IX的浓度,单位为毫克每毫升(mg/mL);
V—试样提取过程中定容体积,单位为毫升(mL);
m—试样称取的质量或量取的体积,单位为克(g)或毫升(mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录A
标准溶液和试样溶液典型液相色谱图


二十、保健食品中总三萜的测定
1 范围
本方法规定了保健食品中总三萜的紫外-可见分光光度测定方法。
本方法适用于以含有三萜类成分为主要原料的保健食品中总三萜含量的测定。
2 原理
试样用氯仿或乙酸乙酯提取出的三萜类物质,在高氯酸的作用下与香草醛反应产生有色物质。以熊果酸为对照品,采用分光光度法测定总三萜在548nm波长下的吸光度进行定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯。
3.1 试剂
3.1.1 乙酸乙酯(CH3COOCH2CH3)。
3.1.2 氯仿(CHCl3)。
3.1.3 冰乙酸(CH3COOH)。
3.1.4 高氯酸(HClO4)。
3.1.5 香草醛(C8H8O3)。
3.2 标准品
熊果酸标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥90%,或经国家认证并授予标准物质证书的标准物质。
表1 熊果酸标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 熊果酸 | Ursolic Acid | 77-52-1 | C30H48O3 | 456.68 |
熊果酸标准品溶液(100μg/mL):精密称取熊果酸标准样品(3.2)10mg,至100mL容量瓶中,加乙酸乙酯(3.1.1)溶解并稀释至刻度,摇匀。
3.4 试剂配制
香草醛冰乙酸溶液(5%):精密称取香草醛(3.1.5)0.5g,加冰乙酸(3.1.3)使溶解成10mL,即得。临用前配制。
4 仪器和设备
4.1 紫外-可见分光光度计。
4.2 分析天平:感量分别为0.01mg和0.0001g。
4.3 恒温水浴锅。
4.4 超声波清洗器。
4.5 离心机。
5 分析步骤
5.1试样制备
5.1.1 固体试样
取一定量混匀试样(软胶囊除外),精密称定(试样中总三萜的量约为0.5~5mg),置50mL量瓶中,加氯仿(3.1.2)约30mL,超声处理30min,放冷,加氯仿至刻度,摇匀。离心,取上清液备用。
5.1.2 油类制品
准确称取混匀试样适量(试样中总三萜的量约为0.5~5mg),置于100mL容量瓶中,用乙酸乙酯(3.1.1)溶解并稀释至刻度,摇匀。
5.1.3 软胶囊制品
取一定量混匀的净胶囊内容物,精密称定(试样中总三萜的量约为0.5~5mg),置于100mL容量瓶中,加乙酸乙酯(3.1.1)约60mL,超声处理30min,放冷,加乙酸乙酯至刻度,摇匀。
5.2 标准曲线的制作
分别精密吸取熊果酸标准品溶液(3.3)0.00、0.10、0.20、0.40、0.80、1.00mL于蒸发皿中,于60℃水浴上蒸干,冷却后精密加入0.4mL5%香草醛冰乙酸溶液(3.4),转动蒸发皿使残渣溶解,再精密加1.0mL高氯酸(3.1.4),混匀后移入10mL具塞比色管中,置60℃水浴加热15min,取出,冰浴冷却后,精密加入冰乙酸5.0mL摇匀,15min后以1cm比色池于548nm波长测定吸光度,以吸光度为纵坐标,浓度为横坐标绘制标准曲线。
5.3 试样溶液的测定
精密量取试样上清液(5.1)1.0mL置蒸发皿中,于60℃水浴上蒸干。照标准曲线的制作(5.2)项下,自“冷却后精密加入0.4mL5%香草醛冰乙酸溶液……”起,同法操作,测定吸光度,根据标准曲线得到待测液中总三萜的浓度。
6 结果计算
试样中总三萜含量按下式计算:

Xi—试样中总三萜含量(以熊果酸计),单位为克每百克(g/100g);
Ci—由标准曲线查得测定样液中总三萜质量,单位为微克(μg);
m—试样的称样质量,单位为克(g);
V1—试样定容总体积,单位为毫升(mL);
V2—测定用试样体积,单位为毫升(mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
二十一、保健食品中虫草素的测定
1 范围
本方法规定了保健食品中虫草素的液相色谱测定方法。
本方法适用于保健品食品中虫草素的测定。
2 原理
试样经酸水溶解,加偏磷酸溶液沉淀干扰物质,反相色谱分离,与标准品的保留时间比较定性,以峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。
3.1 试剂
3.1.1 偏磷酸(HPO3)。
3.1.2 甲醇(CH3OH):色谱纯。
3.2 标准品
虫草素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 虫草素标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 虫草素 | Cordycepin | 73-03-0 | C10H13N5O3 | 251.24 |
3.3.1 虫草素标准储备溶液:精确称取虫草素标准样品(3.2)25.0mg于50mL容量瓶中,用水溶解并定容至刻度,摇匀,此溶液浓度为0.5mg/mL。贮存于-18°C 冰箱中,有效期3个月。
3.3.2 虫草素标准系列工作液:分别准确吸取不同体积的标准储备液(3.3.1),用水将其稀释成虫草素含量分别为 1mg/mL、2mg/mL、5mg/mL、10mg/mL、20mg/mL、50mg/mL 的标准工作液。临用时配制。
3.4 偏磷酸溶液(30.0g/L):称取30.0g偏磷酸(3.1.1),置于装有约600mL水的三角瓶中,在磁力搅拌器上搅拌溶解,转移至1000mL容量瓶中,用水定容至刻度,摇匀,待用。
3.5 微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 分析天平:感量分别为0.0001g和0.001g。
4.3 超声波清洗器。
4.4 离心机:转速≥4000r/min。
4.5 磁力搅拌器。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:取20粒以上片剂或胶囊试样进行粉碎、混匀,或取半固态试样混匀(软胶囊称取内容物),准确称取均匀试样1g(可根据样品中含量而定,精确至0.001g),置50mL容量瓶中,加水30mL,混匀,超声震荡30min,加入30.0g/L偏磷酸溶液(3.4)1.0mL,轻轻振荡,加水稀释至刻度,摇匀。样品经0.45μm 滤膜过滤后进液相色谱分析。
5.1.2 液体样品:准确吸取摇匀后的试样10 mL(可根据试样含量而定)于50mL容量瓶中,加水20mL,混匀,超声震荡30min,加入30.0g/L偏磷酸溶液(3.4)1.0mL,轻轻振荡,加水稀释至刻度,摇匀。样品经0.45μm 滤膜过滤后进液相色谱分析。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱,250 mm×4.6mm,5μm或性能相当者。
5.2.2 流动相:甲醇(3.1.2)+水,(15+85,v/v)。
5.2.3 流速:1.0 mL/min。
5.2.4 柱温:30℃。
5.2.5 检测波长:260nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的虫草素标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液虫草素的色谱峰面积,根据标准曲线得到待测液中虫草素的浓度,平行测定次数不少于两次。
虫草素的标准品和试样液相色谱图参见附录A的图A.1和图A.2。
6 结果计算
试样中虫草素含量按下式计算:
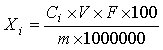
Xi——试样中虫草素的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Ci——由标准曲线查得测定样液中虫草素的浓度,单位为微克每毫升(mg/mL);
V——被测定样液的最终定容体积,单位为毫升(mL);
m——测定用试样的量,单位为克或毫升(g或mL);
100——单位转换;
1000000——单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
附录 A
标准溶液和试样溶液典型液相色谱图


二十二、保健食品中D-甘露醇的测定
1 范围
本方法规定了保健食品中D-甘露醇的高效液相色谱法测定方法。
本方法适用于保健食品中D-甘露醇含量的测定。
2 原理
试样中的D-甘露醇经提取后在氨基色谱柱上分离,用蒸发光散射检测器检测,根据保留时间定性,标准曲线法定量检测。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682 规定的一级水。
3.1 试剂
3.1.1 乙腈(CH3CN):色谱纯。
3.1.2 无水乙醇(C2H5OH)。
3.2 试剂配制
提取液:取40mL水与60mL无水乙醇(3.1.2)混合,即得。
3.3 标准品
D-甘露醇标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99%,或经国家认证并授予标准物质证书的标准物质。
表1 D-甘露醇标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| D-甘露醇 | D-Mannit | 69-65-8 | C6H14O6 | 182.17 |
3.4.1 D-甘露醇标准储备溶液:称取D-甘露醇标准样品(3.3)0.25g(精确至0.0001g),用水溶解,并转移至25mL容量瓶中,定容至刻度,此溶液浓度为10.0mg/mL。贮存于4℃冰箱中,有效期3个月。
3.4.2 标准系列溶液制备:分别准确吸取不同体积的标准储备液(3.4.1),用水将其稀释成D-甘露醇含量分别为0.1mg/mL、0.2mg/mL、0.5mg/mL、1.0mg/mL、2.0mg/mL、4.0mg/mL的标准系列工作液。临用时配制。
4 仪器和设备
4.1 高效液相色谱仪:配有蒸发光散射检测器(ELSD)。
4.2 超声波清洗器。
4.3 离心机:转速≥4000r/min。
4.4 分析天平:感量分别为0.0001g和0.01g。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:取20粒以上片剂或胶囊内容物进行粉碎、混匀,或取半固态试样混匀(软胶囊称取其内容物),准确称取均匀试样0.5g(可根据样品中含量而定,精确至0.001g),置圆底烧瓶中,加入25mL提取液(3.2),混匀,称重,水浴回流60min,取出,冷却后称重,补足减失的重量,摇匀,经0.45μm微孔滤膜过滤,滤液待分析。
5.1.2 液体样品:准确吸取一定量摇匀后的试样10mL(可根据试样含量而定,如少于10mL用水补足10mL)于25mL容量瓶中,加入无水乙醇(3.1.2)10mL,混匀,超声振荡30min,取出,冷却,用无水乙醇定容至刻度。混匀后经0.45μm滤膜过滤,供液相色谱分析用。
5.2 仪器参考条件
5.2.1 色谱柱:氨基液相色谱柱,250 mm×4.6mm,5μm,或同等性能色谱柱。
5.2.2 流动相:乙腈(3.1.1)+水,(25+75,v/v)。
5.2.3 柱温:30℃。
5.2.4 流速:1.0mL/min。
5.2.5 进样量:10mL。
5.2.6 蒸发光散射检测器:气体流速:1.60L/min,漂移管温度:60℃,增益:1。
5.3 标准曲线的制作
将标准系列工作液(3.4.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的标准溶液的色谱峰面积,以D-甘露醇的浓度(C)的对数LogC为横坐标,相应的色谱峰面积(A)的对数LogA为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液D-甘露醇的色谱峰面积,根据标准曲线得到待测液中D-甘露醇的浓度,平行测定次数不少于两次。
D-甘露醇的标准品和样品液相色谱图参见附录A的图A.1和图A.2。
6 结果计算
试样中D-甘露醇含量按下式计算:
X =
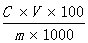
X——试样中D-甘露醇的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
C——由标准曲线查得测定样液中D-甘露醇的浓度,单位为毫克每毫升( mg/mL);
V——被测定样液的定容体积,单位为毫升( mL);
m——试样的称样质量,单位为克或毫升( g或mL);
100——单位转换;
1000——单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
附录 A
标准溶液和试样溶液典型液相色谱图


二十三、保健食品中功效成分/标志性成分食品安全国家标准检测方法
| 序号 | 功效成分/标志性成分 | 推荐方法 |
| 1 | α-亚麻酸、二十碳五烯酸、二十二碳五烯酸、二十二碳六烯酸 | GB 28404 |
| 2 | 前花青素 | GB/T 22244 |
| 3 | 异嗪皮啶 | GB/T 22245 |
| 4 | 泛酸钙 | GB/T 22246 |
| 5 | 淫羊藿苷 | GB/T 22247 |
| 6 | 甘草酸 | GB/T 22248 |
| 7 | 番茄红素 | GB/T 22249 |
| 8 | 绿原酸 | GB/T 22250 |
| 9 | 葛根素 | GB/T 22251 |
| 10 | 辅酶Q10 | GB/T 22252 |
| 11 | 大豆异黄酮 | GB/T 23788 |
| 12 | 褪黑素 | GB/T 5009.170 |
| 13 | 超氧化物歧化酶(SOD) | GB/T 5009.171 |
| 14 | 脱氢表雄甾酮(DHEA) | GB/T 5009.193 |
| 15 | 免疫球蛋白IgG | GB/T 5009.194 |
| 16 | 吡啶甲酸铬 | GB/T 5009.195 |
| 17 | 肌醇 | GB/T 5009.196 |
| 18 | 盐酸硫胺素、盐酸吡哆醇、烟酸、烟酰胺、咖啡因 | GB/T 5009.197 |
| 19 | 维生素B12 | GB/T 5009.217 |
第三部分
溶剂残留的测定
溶剂残留的测定
1 范围
本方法规定了保健食品中正丁醇、异丁醇、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯9种溶剂残留的气相色谱测定方法。
本方法适用于保健食品中正丁醇、异丁醇、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯9种溶剂残留的测定。
2 原理
样品经50% N,N-二甲基甲酰胺溶液提取后,采用顶空-气相色谱法测定,用外标法定量。
3 试剂和材料
注:水为GB/T 6682规定的二级水。
3.1 试剂
N,N-二甲基甲酰胺(HCON(CH3)2):色谱纯。
3.2试剂配制
N,N-二甲基甲酰胺溶液(50%):500mL N,N-二甲基甲酰胺与500mL水充分互溶混合。
3.3 标准品
正丁醇、异丁醇、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥97%,或经国家认证并授予标准物质证书的标准物质。
表1标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
| 中文名称 | 英文名称 | CAS登录号 | 分子式 | 相对分子量 |
| 正丁醇 | 1-Butanol | 71-36-3 | C4H10O | 74.12 |
| 异丁醇 | 2-Methyl-1-propanol | 78-83-1 | C4H10O | 74.12 |
| 正己烷 | Hexanes | 110-54-3 | C6H14 | 86.18 |
| 甲苯 | Toluene | 108-88-3 | C7H8 | 92.14 |
| 对二甲苯 | p-Xylene | 106-42-3 | C8H10 | 106.17 |
| 邻二甲苯 | o-Xylene | 95-47-6 | C8H10 | 106.17 |
| 苯乙烯 | Styrene | 100-42-5 | C8H8 | 104.15 |
| 1,2-二乙基苯 | 1,2-diethylbenzene | 135-01-3 | C10H14 | 134.22 |
| 二乙烯苯 | Divinylbenzene | 1321-74-0 | C10H10 | 130.19 |
3.4.1 标准储备液:分别称取正丁醇、异丁醇标准样品(3.3)1.2g(精确至0.0001g);正己烷、二乙烯苯标准样品(3.3)0.12g(精确至0.0001g);甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯标准样品(3.3)0.1g(精确至0.000 1 g),分别用N,N-二甲基甲酰胺(3.1)溶解,并分别转移至100mL容量瓶中,定容至刻度,得到正丁醇溶液、异丁醇溶液浓度为12mg/mL,正己烷溶液和二乙烯苯溶液浓度为1.2mg/mL,甲苯溶液、对二甲苯溶液、邻二甲苯溶液、苯乙烯溶液、1,2-二乙基苯溶液浓度为1mg/mL。贮存于4℃冰箱中。
3.4.2 混合标准中间液:分别准确吸取上述标准储备液(3.4.1)各1.0mL于同一100mL容量瓶中,用50% N,N-二甲基甲酰胺溶液(3.2)定容至刻度,摇匀。该混合标准中间液中正丁醇、异丁醇浓度为120μg/mL,正己烷、二乙烯苯浓度为12.0μg/mL,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为10.0μg/mL。贮存于4℃冰箱中。
3.4.3 标准系列工作液:分别准确吸取不同体积的混合标准中间液,用50% N,N-二甲基甲酰胺溶液将其稀释成正丁醇、异丁醇浓度分别为0.60μg/mL、2.4μg/mL、6.0μg/mL、12μg/mL、24μg/mL、60μg/mL,正己烷、二乙烯苯浓度分别为0.060μg/mL、0.24μg/mL、0.60μg/mL、1.2μg/mL、2.4μg/mL、6.0μg/mL;甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度分别为0.050μg/mL、0.20μg/mL、0.50μg/mL、1.0μg/mL、2.0μg/mL、5.0μg/mL标准系列工作液。临用时配制。
4 仪器和设备
4.1 气相色谱仪:配有氢火焰离子化检测器(FID)。
4.2 顶空自动进样器。
4.3 顶空瓶:20mL,配备铝盖和不含烃类溶剂残留的丁基橡胶或硅树脂胶隔垫。
4.4 分析天平:感量分别为0.0001g和0.001g。
4.5 超声波清洗器。
5 分析步骤
5.1 试样制备
5.1.1 固体基质
准确称取0.5g试样(精确至0.001g)于20mL顶空瓶中,加入5mL 50% N,N-二甲基甲酰胺溶液混匀后密封,超声处理10min,即得。
5.1.2 液体基质
准确称取1.0g至2.0g试样(精确到0.001g)于10mL容量瓶中,加入50% N,N-二甲基甲酰胺溶液定容至刻度,混匀,准确吸取5mL溶液至20mL顶空瓶中,密封,即得。
5.1.3油类基质
称取0.5g试样(精确到0.001g)于10mL容量瓶中,加入N,N-二甲基甲酰胺(3.1)定容至刻度,混匀,准确吸取5mL溶液至20mL顶空瓶中,密封,即得。
5.2 仪器参考条件
5.2.1 顶空进样参考条件
a)平衡时间:30min。
b)平衡温度:90℃。
c)进样体积:1.0mL。
5.2.2 色谱参考条件
a)色谱柱:以键合/交联聚乙二醇为固定相的毛细管柱,柱长为30m,内径为0.32mm,膜厚度为0.50μm,或性能相当者。
b)柱温箱温度:起始温度40℃,保持5min,10℃/min 升温至150℃,保持1min,再以20℃/min升至200℃,保持2min。
c)进样口温度:200℃。
d)分流比:15∶1。
e)FID 检测器温度:250℃。
f)载气:高纯氮气,流量 1.5mL/min,尾吹30mL/min。
g)氢气流量:40mL/min。
h)空气流量:300mL/min。
5.3 标准曲线的制作
准确吸取各浓度标准系列工作液(3.4.3)5mL置于顶空瓶中,分别按仪器参考条件(5.2)进行测定,得到相应的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按仪器参考条件(5.2)进行测定,得到相应的样品溶液溶剂残留的色谱峰面积,根据标准曲线得到待测液中各溶剂残留的浓度,平行测定次数不少于两次。
各溶剂残留的标准气相色谱图参见附录A的图A.1。
6 结果计算
试样中各溶剂残留含量按下式计算:

X—试样中各溶剂残留的含量,单位为毫克每千克(mg/kg);
C—由标准曲线得出的样液中各溶剂残留的浓度,单位为微克每毫升(μg/mL);
V—供试样溶液的体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%。
8 其它
当称样量为0.5g时,正丁醇、异丁醇检出限为2mg/kg,定量限为6mg/kg,正己烷、二乙烯苯的检出限为0.2mg/kg,定量限为0.6mg/kg,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯检出限为0.08mg/kg,定量限为0.30mg/kg。
附录A
溶剂残留的气相色谱图

图A.1 溶剂残留的气相色谱图
注:1:正己烷; 2:甲苯; 3:异丁醇; 4:对二甲苯; 5:正丁醇; 6:邻二甲苯;7:苯乙烯;8:1,2-二乙基苯;9:二乙烯苯
第四部分
违禁成分的测定
违禁成分测定
| 违禁成分 | 检验方法编号 |
| 2-羟丙基去甲他达拉非;2-羟乙基去甲他达拉非;N-苯丙烯基他达拉非;N-丁基他达拉非;N-去甲基西地那非;N-去乙基-N-甲基伐地那非;N-去乙基伐地那非;N-去乙基红地那非;N-叔丁氧羰基-N-去乙基红地那非;N-辛基去甲他达拉非;N-乙基他达拉非;O-去乙基西地那非;阿伐那非;艾地那非;氨基他达拉非;氨基西地那非;苯噻啶红地那非;苯酰胺那非;吡唑N-去甲基西地那非;苄西地那非;丙氧苯基艾地那非;丙氧苯基硫代艾地那非;丙氧苯基硫代豪莫西地那非;丙氧苯基硫代羟基豪莫西地那非;丙氧苯基硫代西地那非;丙氧苯基羟基豪莫西地那非;丙氧苯基西地那非;丙氧苯基异丁基艾地那非;达泊西汀; 二甲基红地那非;二硫代去甲基卡巴地那非;二硫代去乙基卡巴地那非;伐地那非;伐地那非N-氧化物;伐地那非二聚体;伐地那非哌嗪酮;伐地那非乙酰基类似物;桂地那非;豪莫西地那非; 红地那非;环戊那非;卡巴地那非;硫代艾地那非;硫代豪莫西地那非;硫代西地那非;硫喹哌非;罗地那非碳酸酯;氯地那非;米罗那非;那非乙酰酸;那红地那非;那莫伐地那非;那莫西地那非;哌唑那非;羟基伐地那非;羟基豪莫西地那非;羟基红地那非;羟基硫代伐地那非;羟基硫代豪莫西地那非;羟基硫代红地那非;羟基氯地那非;庆地那非;去甲基卡巴地那非;去甲基硫代西地那非;去甲基哌嗪基西地那非磺酸;去甲基他达拉非;去碳西地那非;去乙基卡巴地那非;双氯地那非;双去碳西地那非;双酮红地那非;他达拉非;他达拉非二氯代杂质;他达拉非甲基氯化物;酮红地那非;脱硫伐地那非;脱哌嗪基硫代西地那非;伪伐地那非;乌地那非;西地那非;西地那非N-氧化物;西地那非二聚体杂质;西地那非杂质12;西地那非杂质14;硝地那非;亚硝地那非;乙酰胺基他达拉非;乙酰伐地那非;异丁基西地那非。 | 国家市场监督管理总局食品补充检验方法(食品中那非类物质的测定BJS201805); 国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2009030。 |
| N,N-双去甲基西布曲明;N-单去甲基西布曲明;安非他明;安非他酮;奥利司他;苯丙醇胺;苯扎贝特;比沙可啶;苄基西布曲明;布美他尼;非诺贝特;分特拉明;芬氟拉明;酚酞;呋塞米; 氟西汀;豪莫西布曲明;甲基安非他明;甲基麻黄碱;咖啡因;利莫那班;洛伐他汀;氯代西布曲明;氯卡色林;氯噻嗪;麻黄碱;普伐他汀;氢氯噻嗪;去甲伪麻黄碱;伪麻黄碱;西布曲明;辛伐他汀;吲达帕胺;洛伐他汀羟酸;美伐他汀;脱羟基洛伐他汀;烟酸;匹可硫酸钠。 | 国家食品药品监督管理总局食品补充检验方法(食品中西布曲明等化合物的测定BJS201701); 国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2006004; 国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2012005; 国家市场监督管理总局食品补充检验方法(食品中匹可硫酸钠的测定BJS201911); 国家食品药品监督管理总局食品补充检验方法(保健食品中75种非法添加化学药物的检测BJS201710)。 |
| 佐匹克隆;罗通定;三唑仑;青藤碱;咪达唑仑;劳拉西泮;氯硝西泮;阿普唑仑;扎来普隆;氯氮卓;艾司唑仑;奥沙西泮;地西泮;硝西泮;文拉法辛;氯苯那敏;氯美扎酮;司可巴比妥;褪黑素;苯巴比妥;异戊巴比妥;巴比妥。 | 国家食品药品监督管理总局食品补充检验方法(保健食品中75种非法添加化学药物的检测BJS201710); 国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2009024; 国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2012004; 国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2013002。 |
版权声明:
1、凡本网注明“来源:中国保健营养网” 的所有作品,版权均属于中国保健营养网,未经本网授权,任何单位及个人不得转载、摘编或以其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:中国保健营养网”。违反上述声明者,本网将追究其相关法律责任。
2、凡本网注明 “来源:XXX(非中国保健营养网)” 的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,相关图文版权归原作者所有。
3、有关作品版权事宜请联系电话:010-64201955 邮箱:cncare2008@126.com。
相关信息







